Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 971 questões
A decomposição de 2,27 g de nitroglicerina nas CNTPs produzirá, ao todo, aproximadamente ________ litros de gases. Assinale a alternativa que completa corretamente a lacuna da frase acima.
Dados: C = 12; H = 1; R = 0.082 atm.L.mol -1 .K-1
I. A pressão parcial do metano é 0,6 atm.
II. A pressão total é 3,44 atm.
III. A fração em mol do butano é aproximadamente 0,5.
IV. A pressão parcial do propano é 0,615 atm.
V. A quantidade de matéria do propano é 0,11 mol.
verifica-se que estão corretas
Dados: H = 1; S = 32; O = 16; Na = 23
Mg2 SiO4 + 4HCl → 2MgCl 2 + 2H2 O + SiO2
MgCl 2 + H2 CO3 → MgCO3 + 2HCl
Nesse processo, a quantidade de silicato de magnésio (em toneladas) necessária para reagir completamente com 6,2 toneladas de ácido carbônico é igual a:
O número de moléculas dessa toxina que corresponde à dose citada corresponde, aproximadamente, a:
Assinale a alternativa que complete corretamente a lacuna.
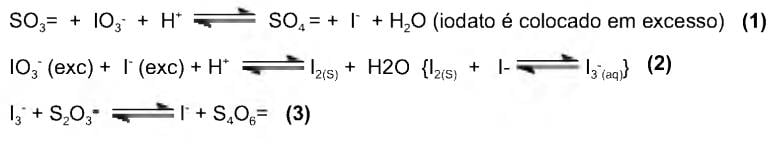
fórmula mínima: C2H5 (dados C = 12g/mol e H = 1g/mol); massa molecular: 58 g/mol.
Com base nessas informações, é correto afirmar que o hidrocarboneto em questão é o
C5H12 (g) + 8 O2 (g) → 5 CO2 (g) + 6 H2O (g),
em que todos os gases estão nas mesmas condições de pressão e temperatura. Com base nessas informações, assinale a opção que corresponde ao volume de oxigênio necessário para produzir 60 m3 de gás carbônico.
A massa, em gramas, de PbI 2 , sólido que se forma ao se misturarem 100,00 mL de cada uma das soluções, é
Dados M(KI) = 166 g/mol M(Pb(NO3)2) = 331 g/mol M(Pbl2) = 461 g/mol
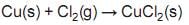
Uma mistura em equilíbrio contém 20 g de Cu, 35 g de Cl2 e 198 g de CuCl2 num recipiente de 2,5 L de capacidade. Identifique a alternativa que apresenta, respectivamente, as concentrações molares (mol/L) do Cu, Cl2 e do CuCl2.
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

concentração de NaCl, em mol/L, no corpo de um adulto corresponde aproximadamente a
Dos mais de 100 elementos químicos que compõem a Tabela Periódica, vinte e um exercem papel vital no organismo humano.
Aparecem de forma combinada nas mais variadas substâncias e participam das reações químicas que ocorrem no organismo, desempenhando diferentes funções. A tabela a seguir reúne os elementos químicos que ocorrem no corpo humano.

Uma amostra contendo 2 g de um cereal enriquecido com ferro (II) foi transferida para um frasco contendo solução aquosa de ácido sulfúrico e em seguida titulada com solução padronizada de KMnO4 , conforme descrito na literatura. A equação iônica da titulação está representada a seguir:
MnO4 – (aq) + 8H+ (aq) + 5Fe2+ (aq) ? Mn2+ (aq) + 4H2 O (l) + 5Fe3+ (aq)
Terminada a titulação, calculou-se que foram consumidos 0,00075 mol de KMnO4 . Sabendo que a massa molar do Fe é 56 g/mol, a quantidade, em g de ferro (II) na amostra analisada é