Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 991 questões
SnCl2(aq) + 2 FeCl3(aq) → SnCl4(aq)+ 2 FeCl2(aq)
Qual a concentração, em quantidade de matéria (mol/L), da espécie Sn 4+ formada?
HA ⇌ A- + H+ ; Ka = 1,0 x 10-4
A alternativa que indica, com melhor aproximação, a concentração, em mol L-1 , de íons H+ na solução é:
SiO2(s)+ C(s)⇌ Si (s) + CO2(g)
Se, em uma certa condição experimental, obteve-se 787 kg de silício a partir de 2.000 kg de SiO2 , o rendimento percentual da reação foi de
Dado
MSi: 28 g mol -1
MO: 16 g mol -1
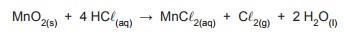
A massa de 1,3 g de dióxido de manganês reage com solução aquosa de ácido clorídrico em excesso produzindo, aproximadamente,
Dado
Constante de Avogadro = 6,0 x 1023
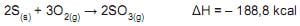
Considerando-se que há excesso de oxigênio e que ocorre reação completa, o valor do calor, em kcal, liberado na formação de 10 mol de SO 3(g) é
O valor mais próximo da massa, em gramas, de K2 Cr 2 O7 presente em uma alíquota de 25,00 mL dessa solução é
Dado M(K2Cr2O7) = 294 g/mol
Dado MM(NaOH) = 40 g/mol
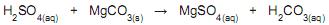
A quantidade, em gramas, de H2SO4 que reage estequiometricamente com o MgCO3 presente no minério é, aproximadamente, igual a
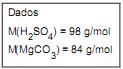
Na produção de ácido acrílico (ácido propenoico) a partir do eteno, acima representada, para uma alimentação estequiométrica contendo apenas os reagentes, foi produzido 0,8 mol do ácido carboxílico para cada mol de eteno alimentado.
Logo, a razão molar Ácido/O2 igual a obtida na saída do reator é igual a:
I. A densidade também pode ser considerada como sendo 9,00.102 g/L.
II. Se um rótulo informa que tem 50,0Kg de etilenodiamina, então, o volume da embalagem tem que ser maior do que 100L.
III. É possível considerar que o teor de etilenodiamina é 90,0%(m/v).
IV. A concentração da solução de etilenodiamina pode ser considerada como sendo 15,0mol/L.
É correto o que se afirma em
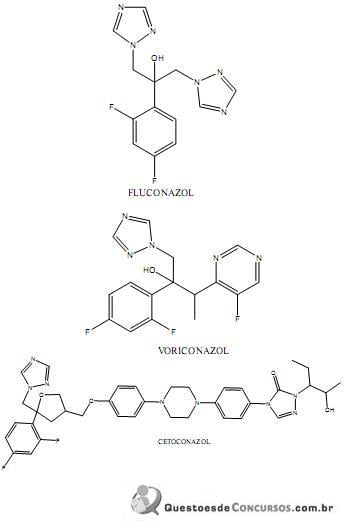
Diante do exposto, assinale a alternativa incorreta.
Pb(NO3)4(s) → Pb(s) + N2O4(g) + O2(g)
(Dado de massas molares (g/mol): Pb(NO3)4 = 455; Pb = 207; N2O4 = 92, O2 = 16)
Então, é correto afirmar que a massa total de nitrato de chumbo (IV) presente na amostra é de, aproximadamente,
(Dados: massas molares (g/mol): Mg = 24; Cl = 35,5; H = 1; O = 16)
Na2SO4(aq) + BaCl2 (aq) → NaCl(aq) + BaSO4 (s)
(Dados de massas atômicas (u): Na = 23; S = 32; O = 16; Ba = 137; Cl = 35,5)
Se 50,00mL da solução de sulfato de sódio consome 12,25mL de uma solução a 0,02mol/L de cloreto de bário, assinale a alternativa que apresenta a massa de sulfato de sódio presente.
Na2S2O3(aq)+ I2(aq) → Na2S4O6(aq)+ NaI(aq)
Diante do exposto, assinale a alternativa que apresenta a concentração de iodo presente na solução estoque.
Dados
Massa atômica do cálcio = 40 g
Massa atômica do fósforo = 31 g
Massa atômica do oxigênio = 16 g