Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
 , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
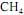 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 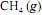 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se que as capacidades caloríficas fornecidas na tabela sejam válidas para o intervalo de temperaturas entre 25 ºC e 35 ºC, é correto afirmar que a combustão do
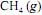 deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.
deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC. 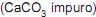 que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado.
que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado. O teor de carbonato de cálcio na amostra de minério analisada é
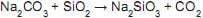
A cor do vidro muitas vezes depende das impurezas de ferro que estão presentes na areia quando o vidro é formado.
Empregando-se 1 tonelada de areia
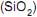 contendo 4% de impurezas em ferro na fabricação do vidro, a quantidade de litros de gás recolhido a 27ºC, considerando que esse processo seja realizado na cidade do Rio de Janeiro, é
contendo 4% de impurezas em ferro na fabricação do vidro, a quantidade de litros de gás recolhido a 27ºC, considerando que esse processo seja realizado na cidade do Rio de Janeiro, é 
Baseado nestas informações, é correto afirmar que:
Baseado nessas informações, é INCORRETO afirmar que:
A concentração de e ácido ascórbico (massa molar 176 g.mol -1 ), em um suco extraído de laranjas, é de 0,704 g.L –1.
O número de mols de ácido ascórbico, em 250 mL do suco destas lanrajas, é:
Considere a reação de combustão total da estearina, balanceada com os menores coeficientes inteiros, produzindo dióxido de carbono e água. A soma destes coeficientes é igual a:

FeS + 2HCl → FeCl2 + H2S
A massa máxima de gás sulfídrico que pode ser obtida nesse procedimento é:
Dados: Massas molares H = 1g.mol –1 , S= 32 g.mol –1 Cl= 35,5 g.mol –1 Fe= 56g.mol –1
4NH3(g) + 3O2(g) → 2N2(g) + 6H2O(g)
Considerando que a reação foi completa, é possível observar que, em um recipiente fechado, a pressão do sistema deverá
Valores dos pesos atômicos dos elementos:
Valores dos pesos atômicos dos elementos:
Elemento -------- Peso atômico (g/mol)
Carbono --------- 12,011
Hidrogênio ------ 1,008
Oxigênio -------- 15,999
CH4 + 202 - > CO2 + 2H2O