Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 991 questões
Tratando-se 0,5 kg de nitrato de potássio pelo ácido sulfúrico, a quente, ocorre a formação de sulfato de potássio e ácido nítrico. Sabendo-se que o rendimento da reação é de 90%, a massa (em gramas) de ácido nítrico obtida é de:
Dados: K=39; N=14; S=32
Certa amostra pesando 805 g é formada por Na2 SO4 . 10 H2 O e 20% de umidade. A percentagem em peso de sódio na amostra úmida é de:
Dados: Na=23; S=32; O=16; H=1
A massa, em gramas, de magnésio que encerra o mesmo número de átomos que 9,0 g de alumínio é de:
Dados: Mg=24 e Al= 27
Certo gás “X” escapa por um orifício com velocidade 1,2 vezes maior que o oxigênio. Dessa forma, a massa molecular desse gás “X” é:
Dado: O=16
Um composto é formado de 92,32% de carbono e 7,68% de hidrogênio. Nas condições normais de temperatura e pressão (CNTP), 11,2 L de seu vapor pesam 39 g. A sua fórmula molecular é:
Dados: C=12 e H=1.
Uma amostra de 0,265 g de um antibiótico em pó foi dissolvida em HCl e completou-se o volume até 100,00 mL de solução. Uma alíquota de 25,00 mL foi transferida para um balão, seguida da adição de 25,00 mL de solução aquosa 0,018 mol.L–1 de KBrO3. Um excesso de KBr foi adicionado para formar Br2, segundo a equação a seguir: BrO3– + 5Br – + 6H+ → 3Br2 + 3H2O
O bromo formado reage com toda a sulfanilamida presente no antibiótico e, após um tempo, é adicionado excesso de KI, para reagir com o excesso de bromo, formando I2. Finalmente, o iodo formado é titulado, consumindo 13,00 mL de uma solução aquosa 0,12 mol.L–1 de tiossulfato de sódio. As demais equações químicas são:
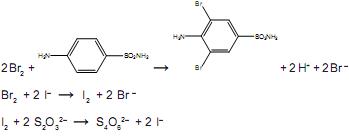
A porcentagem de sulfanilamida presente na amostra do antibiótico em pó é aproximadamente igual a:
Dado: Massa molar da sulfanilamida= 172 g. mol -1
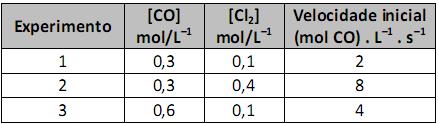
O valor da constante da velocidade, em L . mol–1 . s–1, para esse experimento é de, aproximadamente,
 , cuja equação de combustão é
, cuja equação de combustão é . A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
. A tabela a seguir mostra os dados termodinâmicos, a 25 ºC, relativos aos compostos envolvidos na equação apresentada.
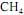 ocorra de forma completa; que a entalpia padrão de combustão do
ocorra de forma completa; que a entalpia padrão de combustão do 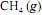 , a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.
, a 25 ºC, seja igual a - 890 kJ/mol; e que as massas molares, em g/mol, do C, do H e do O sejam iguais a 12,0, 1,0 e 16,0, respectivamente.Considerando-se que as capacidades caloríficas fornecidas na tabela sejam válidas para o intervalo de temperaturas entre 25 ºC e 35 ºC, é correto afirmar que a combustão do
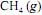 deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC.
deverá liberar maior quantidade de calor se for realizada a 35 ºC, e não a 25 ºC. 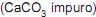 que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado.
que pesa 2,0 g foi precipitada na forma de oxalato de cálcio na dissolução com ácido oxálico, obtendo-se 2,048 g de precipitado. O teor de carbonato de cálcio na amostra de minério analisada é