Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Ao final, ele obteve um suco com concentração hidrogeniônica de
A massa de bórax necessária para preparar 1L de uma solução a 0,1mol/L é
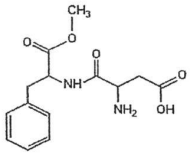
Fonte: FUNCERN, 2015.
Sabendo que a fórmula molecular da sacarose é C12H22O11, a quantidade de sacarose que corresponderá a 5 g de aspartame é
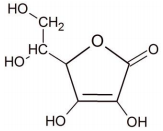
Fonte: FUNCERN, 2015.
Sabendo que um comprido efervescente contém 1 g desta vitamina, a relação entre a quantidade ingerida de vitamina C e a quantidade indicada para ingestão é
A transformação de carbonato de cálcio em óxido de cálcio pode ser representada pela equação a seguir:
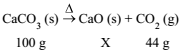
A massa, em gramas, correspondente a X é igual a
Este relato é um histórico importante sobre o elemento ferro, que pode ser obtido através da hematita (óxido férrico). Para a formação da hematita ocorre uma reação entre ferro metálico e gás oxigênio. Considerando este processo químico, quantas gramas de hematita, podem ser obtidas quando 20 mols de ferro reagem com quantidade suficiente de oxigênio? Assinale a alternativa CORRETA.
1ª análise: foram gastos na titulação 21,3 mL da amostra de NaOH.
2ª análise: foram gastos na titulação 22,0 mL da amostra de NaOH.
3ª análise: foram gastos na titulação 21,5 mL da amostra de NaOH.
(Dado: equação da reação, NaOH(aq) + HOOCC6H4COOK(aq) → NaOOCC6H4COOK(aq) + H2O(liq); NaOH = 40,00 g mol-1 e KHC8H4O4 = 204, 22 g mol-1).
A concentração da solução de NaOH padronizada é:
NaHCO3 + HCl → NaCl + H2O + CO2
Podemos afirmar que o grau de pureza da amostra de bicarbonato de sódio é
O cloreto de magnésio tem sido muito usado como uma cura natural para muitos males do corpo humano. Ele pode ser obtido por meio da reação:
Mg (s) + 2 HCl (aq) → MgCl2 (aq) + H2 (g)
Quantos gramas de cloreto de magnésio podem ser obtidos quando 140 g de magnésio reagem com 355 g de ácido clorídrico?
Dados: massas atômicas: H = 1 u; Mg = 24 u; Cl, 35,5 u
“Cerca de 60% do nosso corpo é composto por água. Esse líquido precioso é fundamental para manter o sangue em circulação, controlar a temperatura e permitir inúmeras reações químicas que ocorrem a todo instante no organismo. Em dias normais, perdemos aproximadamente 2,5 litros de água pela respiração, pela urina, pelo suor e, em menor escala, pelas fezes. Claro que no verão ou após uma atividade física intensa, a perda pode ser maior.” Indique a alternativa que apresenta o número de átomos de oxigênio que são perdidos pela respiração, de acordo com o texto acima.
Dados: massas atômicas: H = 1 u; O = 16 u; N =; dágua = 1,0 g/mL 6,0 x 1023