Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 991 questões
Um técnico de laboratório preparou 100 mL de uma solução aquosa de hidróxido de sódio (com massa molar igual a 40 g.mol−1), utilizando 1,6 g de NaOH.
Considerando-se que, nesse caso hipotético, a pureza do hidróxido de sódio seja igual a 100%, a concentração dessa solução preparada, em mol por litro (mol.L−1), será igual a
Considere as afirmativas abaixo e depois responda:
I. Para o preparo de uma solução a 10% de cloreto de sódio (NaCl) em água é necessário dissolver exatos 10g de NaCl em exatos 100 mL de água;
II. Uma solução 1N de NaCl pode ser preparada pela dissolução de 1 equivalente-grama de NaCl em 100 mL de solução;
III. Uma solução 5 Molar de NaCl deve conter 5 moles do soluto em 100 do solvente.
85,5 g de sacarose (C12H22O11) são dissolvidos em 180 g de água. A fração molar da solução é igual a
Dados: H = 1u; C = 12 u; O = 16 u.
O carbonato de cálcio reage com o ácido bromídrico produzindo brometo de cálcio de acordo com a reação apresentada abaixo:
CaCO3 + HBr → CaBr2 + H2O + CO2
Indique a massa, em gramas, de brometo de cálcio obtida quando 20 g de carbonato reagem com 15 g de ácido bromídrico. Considere que Ca = 40 u; C = 12 u; O = 16 u; H = 1u e Br = 80u.
O ácido benzoico foi descoberto no século XVI e recebeu esse nome por ter sido extraído do benjoeiro.
Em 1875, Salkowski verificou que esse ácido atua como fungicida
e, desde então, o ácido benzoico vem sendo usado como
germicida na preservação de alimentos e como adjuvante
farmacológico anti-fúngico, normalmente em concentrações que
variam entre 0,05 a 0,15%. Trata-se de um composto de fórmula
molecular C7H6O2 (massa molar = 122 g.mo -1) pouco solúvel em
água.
-1) pouco solúvel em
água.
Em uma solução aquosa, comporta-se como um ácido fraco, com pKa = 4.
Uma solução aquosa de ácido benzoico em concentração 0,12%
(m/v) apresenta pH aproximadamente igual a
Na determinação do teor de acidez de uma amostra de suco de laranja comercial, 10,00 mL de amostra foram levados para erlenmeyer. Adicionou-se água destilada até completar cerca de 50 mL, 3 gotas de fenolftaleína e titulou-se contra solução padrão de NaOH até mudança de coloração. Na titulação, foram gastos 3,90 mL de solução padrão 0,100 mol.L-1.
A acidez é expressa em termos do teor (porcentagem massa/volume) de ácido cítrico, cuja fórmula estrutural é apresentada a seguir.
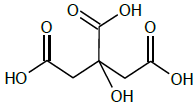
Assinale a opção que expressa a acidez da amostra.
Dados. Massa molar. Ácido Cítrico: 192 g.mol-1.
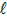 : 74,5; BaSO4: 233
: 74,5; BaSO4: 233A análise da concentração de ortofosfato em corpos d’água pode ser feita utilizando o método colorimétrico. Nesse método, o reagente combinado contendo K(SbO)C4H4O6, (NH4)6Mo7O24 e ácido ascórbico reage em meio ácido com o ortofosfato, produzindo uma cor azul, cuja intensidade é determinada no espectrofotômetro.
No preparo de 100 mL do reagente combinado utiliza-se 5 mL de uma solução de K(SbO)C4H4O6 3,5 g.L-1 e 15 mL de uma solução de (NH4)6Mo7O24 40 g.L-1.
Nessa solução do reagente combinado as concentrações
aproximadas (em g.L-1 ) de K(SbO)C4H4O6 e de (NH4)6Mo7O24 são,
respectivamente,
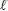 )
) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
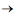 CH4
(g) + 2 H2O(l)
CH4
(g) + 2 H2O(l) Esta reação, descoberta pelo químico francês Paul Sabatier, tem sido estudada para remover CO2 de atmosferas artificiais como em espaçonaves. Considerando que um indivíduo libere para o ambiente 0,6 kg de dióxido de carbono por dia, e que 80% desse gás será removido pelo processo de Sabatier, a massa de metano produzida por dia é de Dados: Massas Molares: H = 1g.mol-1 C = 12g.mol-1 O=16g.mol-1
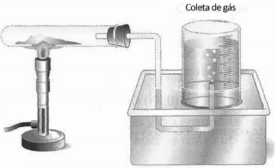
A reação observada pode ser representada pela equação: 2 KClO3 → 2 KCl + 3 O2 Uma amostra de clorato de potássio foi parcialmente decomposta sendo a pressão do gás recolhido de 0,8 atm e seu volume de 180 mL na temperatura de 27ºC. Considerando o comportamento ideal do gás, a massa de clorato de potássio que sofreu decomposição foi de, aproximadamente, Dados: Massa Molar: KClO3 = 122,5 g.mol-1 Constante real dos gases R= 0,082atm.L.mol-1 .K-1
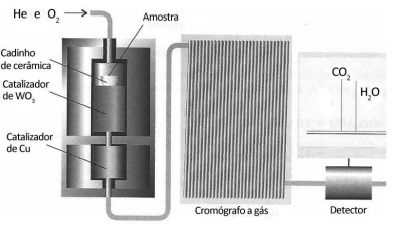
Na análise por combustão de 6,0 g de um hidrocarboneto recém-sintetizado foi determinada a massa de 17,6 g de dióxido de carbono e 10,8 g de água. A fórmula empírica desse composto é: Dados: Massas Molares: H = 1g.mol–1 C = 12g.mol–1 O=16g.mol–1
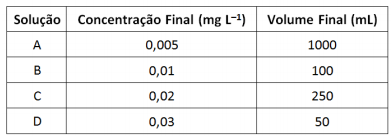
Sobre as soluções preparadas são feitas as afirmativas a seguir. I. Para preparar as soluções A e C foram utilizados os mesmos volumes da solução padrão. II. Para preparar a solução B foi utilizado o menor volume da solução padrão. III. Para preparar a solução D foi utilizado o maior volume da solução padrão. Está correto o que se afirma em
1. Capacidade ( ) Metro cúbico 2. Volume ( ) Metro quadrado 3. Área ( ) Litro 4. Comprimento ( ) Grama 5. Massa ( ) Metro