Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 971 questões
Com a finalidade de averiguar os níveis de concentração de cobre e níquel na água de um reservatório que continha uma liga desses metais e que não continha outros metais além desses, um perito recolheu 1 L da água desse reservatório e reduziu esse volume a 100 mL por evaporação. A titulação dessa solução diluída contendo os cátions requereu 55 mL de uma solução de EDTA 0,02 mol/L. Em seguida, excesso de ácido mercaptoacético em meio amoniacal foi adicionado, de maneira a complexar seletiva e quantitativamente os íons Cu2+, liberando quantidade equivalente de EDTA. Essa amostra foi titulada com uma solução de Mg2+ 0,1 mol/L, requerendo 4 mL para o ponto final.
Considerando que, para esse tipo de tanque, os níveis de concentração toleráveis para esses metais sejam de 30 mg/L para cada íon, assinale a opção correta.

Nessa situação, considerando que a estequiometria da reação de neutralização entre o biftalato e o NaOH seja de 1:1, é correto afirmar que a concentração da referida solução de NaOH é igual a
|
substância |
densidade(g/mL) |
Massa molar (g/mol) |
|
água |
1,00 |
18 |
|
etanol |
0,80 |
46 |
Tendo em vista as massas molares e as densidades da água e do
etanol apresentadas na tabela precedente, se uma solução for
preparada a partir da mistura de 144 mL de água e 115 mL de
etanol, então a concentração de etanol na solução, expressa em
termos de porcentagem em massa e de fração de quantidade de
matéria, será igual, respectivamente, a
Leia o texto e observe a figura abaixo, para responder à questão.
O ácido acetilsalicílico, medicamento mais consumido no mundo, é um fármaco do grupo dos anti-inflamatórios não esteroides (AINE), utilizado como anti-inflamatório, antipirético e analgésico. A figura abaixo mostra a reação da síntese do ácido acetilsalicílico.

A massa molar do composto I, em g/mol é:
(Massas atômicas, em u.m.a.: C = 12; O = 16; H = 1)
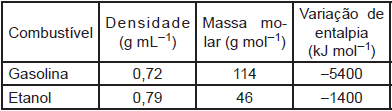
Comparando-se a combustão completa de 1,0 L de cada combustível, verifica-se que a razão entre o calor produzido pela gasolina e o produzido pelo etanol é:
CNTP: 1 atm e 273 K R = 0,082 atm L mol-1 K-1
Desses parâmetros, o único cuja unidade NÃO está diretamente relacionada com massa, quantidade de matéria ou concentração é.

