Questões de Química - Grandezas: massa, volume, mol, massa molar, constante de Avogadro e Estequiometria. para Concurso
Foram encontradas 961 questões
Numa viagem de 200 km, com o carro consumindo, na média, 10 km/L, ao concluir esse percurso, a quantidade máxima de energia liberada, em kJ, será, aproximadamente, igual a
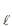 ) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.
) e 1,0 mol de amônia (NH3 ). Esses gases reagem (ver reação abaixo) com um rendimento de 80%.HC
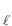 (g) + NH3(g) ? NH4 C
(g) + NH3(g) ? NH4 C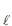 (s)
(s)Considerando-se a pressão de vapor do NH4 C
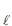 insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, é
insignificante e o comportamento ideal para os gases, a pressão total, em atm, no reator, após a reação, éDado: R = 0,082 atm · L · mol -1· K-1
A concentração da espécie MnO4- , em mol/L, nessa solução, é
Dado: M(KMnO4 ) = 158 g/mol
A massa de NaOH, em g, que deve ser utilizada para neutralizar todo o ácido sem que haja excesso de base é
Dados:
M(KOH) = 56 g/mol
M(NaOH) = 40 g/mol
AgNO3 (aq) + KI (aq) ? AgI (s) + KNO3 (aq)
Levando-se em conta a estequiometria da reação e o conceito de reagente limitante, e sendo as massas molares do AgNO3 = 170 g/mol e do KI = 166 g/mol, após a reação
Considerando os limites desse método e os resultados experimentais dessa análise, a concentração em g/L, de NaCl na amostra é
Dado: M(NaCl) = 58.5 g/mol
A massa aproximada de
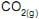 , em g, produzida na queima completa de 100 g dessa mistura é
, em g, produzida na queima completa de 100 g dessa mistura é  , etano
, etano 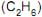 e propano
e propano 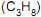 . Todos se encontram na pressão de 1 atm e a na mesma temperatura.
. Todos se encontram na pressão de 1 atm e a na mesma temperatura. Supondo os gases ideais e as suas características, considere as afirmativas abaixo.
I - O volume de oxigênio necessário para a combustão completa de todos os gases contidos nos três balões é o mesmo.
II - A densidade do etano é maior do que a do metano e menor do que a do propano.
III - A massa de propano contido num dos balões é igual à soma das massas do metano e etano contidos nos outros dois balões.
É correto APENAS o que se afirma em
A 25,00 mL dessa solução adicionou-se, lentamente e com agitação constante, uma solução aquosa de hidróxido de amônio até a precipitação completa de hidróxido de Fe III (Reação I).
Fe3+ (aq)+ 3 OH - (aq) → Fe(OH) 3(s) Reação I
Após envelhecimento do precipitado em sua água-mãe, procedeu-se à filtração e à lavagem do precipitado. O precipitado foi transferido para um cadinho previamente tarado, onde foi feita a sua calcinação (Reação II).
2Fe(OH) 3(s) → Fe2 O 3(s) + 3H2 O(g) Reação II
Sendo a massa de Fe2 O3(s)obtida após a calcinação, igual a 0,40 g, qual a concentração de Fe 3+ na solução original, em g/L?
Dados:
massa molar do Fe = 56 g/mol
massa molar do Fe2 O3 = 160 g/mol
Na2 SO4(aq)+ BaCl 2(aq)→ BaSO 4(s)+ 2NaCl (aq)
A quantidade máxima de sulfato de bário que se forma é, aproximadamente, de
A porcentagem de CaCO3 presente nesse calcário é
Sabendo-se que um mol desse ácido tem 98 g, qual a concentração em mol/L dessa solução?
Zn + HCl → ZnCl2 + H2
A massa de HCl necessária para reagir completamente com 130 g de zinco é
Dados: mH = 1u, mCl = 35u e mZn = 65u
Ca + 2 H2 O → Ca(OH) 2 + H2
Qual a massa, em gramas, de H2 produzido na reação?
Dados: mH = 1u, mO = 16u e mCa = 40u
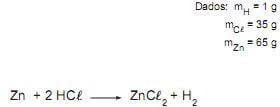

Qual a massa, em gramas, de gás carbônico que é produzida nessa reação se são consumidos 100 g de carbonato de cálcio?
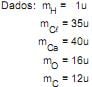
 em peso), completando-se com água até um volume final de 2,0 L.
em peso), completando-se com água até um volume final de 2,0 L. Qual o teor residual de prata na solução?
Dado: Ks AgC
 = 1,8 x 10-10
= 1,8 x 10-10 Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
Considerando-se que o percentual em massa de HCl no estoque é 36,5% e sua densidade específica é 1,2, é CORRETO afirmar que a concentração da solução preparada pelo técnico é igual a