Questões de Concurso
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 971 questões
A porcentagem de CaCO3 presente nesse calcário é
Sabendo-se que um mol desse ácido tem 98 g, qual a concentração em mol/L dessa solução?
Zn + HCl → ZnCl2 + H2
A massa de HCl necessária para reagir completamente com 130 g de zinco é
Dados: mH = 1u, mCl = 35u e mZn = 65u
Ca + 2 H2 O → Ca(OH) 2 + H2
Qual a massa, em gramas, de H2 produzido na reação?
Dados: mH = 1u, mO = 16u e mCa = 40u
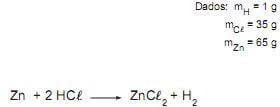

Qual a massa, em gramas, de gás carbônico que é produzida nessa reação se são consumidos 100 g de carbonato de cálcio?
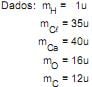
 em peso), completando-se com água até um volume final de 2,0 L.
em peso), completando-se com água até um volume final de 2,0 L. Qual o teor residual de prata na solução?
Dado: Ks AgC
 = 1,8 x 10-10
= 1,8 x 10-10 Na reação de combustão do metano, qual é a quantidade de O2 (g), em mols, necessária para que 6 mols de CH4 (g) sejam completamente consumidos na reação, produzindo CO2 (g) e H2 O?
Considerando-se que o percentual em massa de HCl no estoque é 36,5% e sua densidade específica é 1,2, é CORRETO afirmar que a concentração da solução preparada pelo técnico é igual a
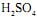 de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada,
de concentração igual a 2,5 mol/L tombou e quebrou-se numa bancada de laboratório. Todo o ácido nela contido espalhou-se pela bancada. Para neutralizálo completamente pode-se utilizar, no mínimo, uma massa de cal hidratada, 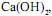 em gramas, igual a
em gramas, igual a 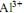 em concentração igual a 0,1 mol/L. Ele tem disponível para isso o sal
em concentração igual a 0,1 mol/L. Ele tem disponível para isso o sal 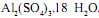 A massa desse sal que o técnico deve utilizar é, em gramas, aproximadamente igual a
A massa desse sal que o técnico deve utilizar é, em gramas, aproximadamente igual a 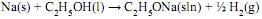
Para eliminar um resíduo de 230 mg de sódio, a massa necessária de etanol é, em miligramas, igual a
Dados
MO = 16 g mol -1
MN = 14 g mol -1
MH = 1 g mol -1
5H2 C2 O4 + 2KMnO4 + 6H+
→
10 CO2 + 2Mn2+ + 8H2 OO volume, em mL, de solução de KMnO4 0,165 mol/L, necessário para reagir com 108 mL de ácido oxálico, de igual concentração molar, é
Sobre essa solução, é correto afirmar que
Dado: massa molar Mg(NO3 )2= 148 g. mol –1
A massa de NaCl contida em uma medida rasa de sal de cozinha é superior a 1,00 g.
Considerando o texto acima e que as massas molares de H, C, O e Cl sejam, respectivamente, 1,0 g/mol, 12,0 g/mol, 16,0 g/mol, 35,5 g/mol, julgue os itens que se seguem.
A sacarose apresenta massa molar igual a 358,0 g/mol.
H2 + 1/2 O2 → H2O
Nesse processo, quantos mols de O2 são necessários para produzir 10 mols de H2 O?