Questões de Concurso Comentadas sobre química
Foram encontradas 7.318 questões

O íon acima representado possui:
2 Al(s) + 2 KOH(aq) + 6 H2O(l) → 2 KAl(OH)4(aq) + 3 H2(g) (etapa 1)
2 KAl(OH)4(aq)+ H2SO4(aq) → 2 Al(OH)3(s) + 2 H2O(l) + K2SO4(aq) (etapa 2)
2 Al(OH)3(s)+3 H2SO4(aq)+K2SO4(aq) → 2 KAl(SO4)2(s) + 6 H2O(l) (etapa 3)
a Al(s)+b KOH(aq)+c H2SO4(aq) →d KAl(SO4)2(s)+e H2O(l)+f H2(g) (reação total)
Após realizar o balanceamento da equação da reação total, assinale a alternativa que indica o somatório dos índices (a+b+c+d+e+f).
MgO(s) + 2 HCl(aq) → MgCl2(aq) + H2O(l)
Calcule a massa de óxido de magnésio necessária para neutralizar 0,06 mol de ácido clorídrico contido no estômago de uma pessoa.
Dados: massas molares em g.mol-1 : H = 1; O = 16; Cl = 35,5; Mg = 24,3.
Dados: massas molares em g.mol-1 : C = 12; O = 16. Volume molar dos gases a 1 atm e 30°C = 25 L.mol-1 . Solubilidade do CO2(g) no refrigerante a 5°C e sob 1 atm de CO2(g) = 3,0 g.L-1 .
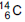 (emissor de partículas
(emissor de partículas 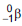 com tempo
de meia-vida de 5.730 anos), de acordo com a
equação da reação:
com tempo
de meia-vida de 5.730 anos), de acordo com a
equação da reação: 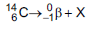
Qual é a substância X formada após a desintegração do isótopo
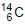 ?
?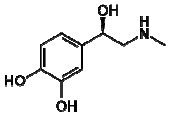
analise as seguintes afirmações.
1) A adrenalina apresenta os grupos funcionais fenol e amida.
2) É um composto aromático e apresenta isomeria ótica.
3) Apresenta uma amina secundária.
Está(ão) correta(s):
1) Areia e sal de cozinha 2) Areia e ar 3) Água e sal de cozinha 4) Óleo de soja e água
( ) Filtração ( ) Destilação ( ) Dissolução seguida de filtração ( ) Decantação
A sequência correta é:
Dados: Massas molares em g . mol−1 : O = 16; K = 39; Cr = 52.
A região de Mariana (MG) é reconhecida pela atividade de extração de minério de ferro. No processo, impurezas e substâncias químicas são destinadas a uma barragem de rejeitos, onde ficam retidas e formam uma espécie de lama. Em 2015, com o rompimento da barragem da Samarco, em Mariana, 62 milhões de m3 de dejetos foram despejados provocando o maior desastre ambiental do país: arrasou um ecossistema, matou 13 pessoas, deixou milhares sem casa e continua colocando em risco o organismo da população. A lama tóxica representa grande perigo à saúde das comunidades, pois contém metais pesados como arsênio, mercúrio e chumbo, além de alumínio. (Revista Saúde - Editora Abril, dezembro de 2015, pgs. 50 e 51).
Sobre os metais citados acima, é correto afirmar que:
A respeito da energia livre de Gibbs, quando um processo ocorreu à pressão e temperatura constantes, um químico fez as seguintes ponderações:
I. Se a variação da energia livre de Gibbs for negativa, a reação química será espontânea num sentido direto da equação química. II. Se a variação da energia livre de Gibbs for nula, a reação química será não espontânea num sentido direto da equação química. III. Se a variação da energia livre de Gibbs for positiva, a reação inversa será espontânea.
Estão corretas as ponderações
Um estudante misturou, acidentalmente, dois frascos de solução aquosas básicas, uma de 300 mL de hidróxido de sódio 0,2 mol/L e outra de 100 mL de hidróxido de potássio.
Considerando que a concentração de íons hidróxidos na mistura foi de 0,3 mol/L, é correto afirmar que a razão entre as concentrações, em mol por litro, dos íons K+ e Na+ após a mistura é igual a
Nesse caso, é correto afirmar que o tipo de reação e o reagente utilizado para essa reação são, respectivamente,
Considerando que a viragem ocorreu após consumir 20 mL do ácido, em porcentagem, qual é o grau de pureza aproximado do hidróxido de sódio?