Questões de Concurso Sobre química
Foram encontradas 14.919 questões
Por volta de 1920, dois cientistas, o bioquímico russo Aleksandr I. Oparin (1894 - 1980) e o biólogo inglês John B. S. Haldane (1892 - 1964) apresentaram seus resultados baseados no estudo da teoria da evolução química do biólogo inglês Thomas H. Huxley (1825 - 1895). Segundo a teoria, a Terra primitiva continha compostos químicos inorgânicos, que combinados a fenômenos físicos como descargas elétricas produziriam compostos orgânicos, que são a base da vida na Terra. Porém, esta hipótese só foi testada em laboratório em 1953 pelos cientistas Stanley L. Miller (1930 - 2007) e Harold C. Urey (1893 - 1981).
PILLING, S. Química prebiótica e formas de vida primitiva. Astroquímica, Universidade do Vale da Paraíba. Disponível em: <https://www1.univap.br/spilling/AQ/Aula%2015%20- %20Quimica%20prebiotica.pdf>. Acesso em: 13 ago. 2023.
A hipótese de Oparin e Haldane foi testada por Miller e Urey, que inseriram em um sistema fechado vapor de água e os gases
Observe a imagem a seguir.

A que tipo de presença de substância essa placa faz alerta aos usuários do laboratório?
Assinale a alternativa que preencha correta e respectivamente as lacunas.
Com base nessas informações, assinalar a alternativa CORRETA:
( ) As substâncias inicialmente presentes em um sistema e que se transformam em outras devido à ocorrência de uma reação química são denominadas reagentes. Novas substâncias produzidas são chamadas de produtos.
( ) Um tipo bastante importante de reação química são as reações de decomposição, reações químicas nas quais uma única substância reagente origina como produtos duas ou mais substâncias.
( ) Algumas evidências de modo geral estão associadas à ocorrência de uma reação química. Podemos citar como exemplo a mudança de cor ou a produção de gás.
( ) Para haver a combustão do etanol, é necessária a presença de oxigênio, liberando somente água como produto final.
A água pode se apresentar em três estados físicos: o sólido, o líquido e o gasoso. As mudanças de estado físico e suas denominações estão representadas no esquema abaixo:
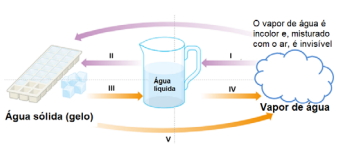
Considerando-se que cada mudança de estado físico está
representada pelos algarismos romanos, analisar os itens
abaixo:
I. Condensação.
II. Solidificação.
III. Fusão.
IV. Vaporização.
V. Sublimação.
Está(ão) CORRETO(S):
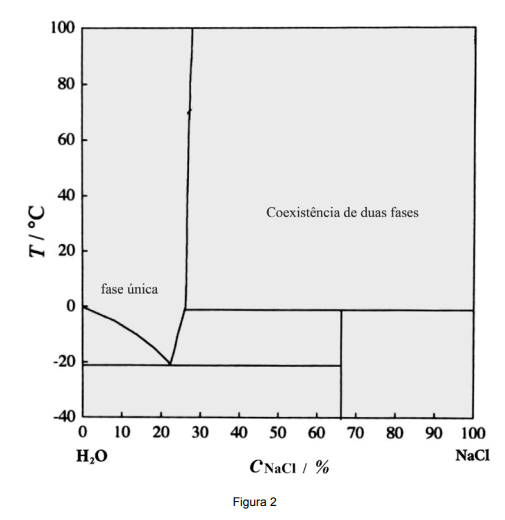
K. Endoh, H. Suga. Thermochimica Acta 327, 1999, p. 134. (Adaptado).
Assinale V (verdadeiro) ou F (falso) diante de cada afirmativa a seguir.
( ) Água com 22% de sal solidifica por volta de -21 ºC.
( ) Em 0 ºC, a água se solidifica para concentrações de sal maiores que 25%.
( ) O gelo flutuando no oceano contém sal de acordo com a linha de liquidus.
( ) A concentração máxima de sal dissolvido em água é de 26% em 20 ºC.
Assinale a alternativa com a sequência correta.
Coluna 1 1. Densidade. 2. Concentração comum. 3. Normalidade.
Coluna 2
( ) Corresponde à relação entre a massa do soluto e o volume da solução. Pode ser expressa em g/L.
( ) É uma importante propriedade física da matéria, correspondendo à relação entre a massa da solução e o volume da solução. Pode ser expressa em g/cm³.
( ) É a relação entre o equivalente-grama do soluto (eg) e o volume da solução (em litros, por exemplo).
A ordem correta de preenchimento dos parênteses, de cima para baixo, é: