Questões de Concurso Sobre química
Foram encontradas 14.093 questões
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
Considere que m1 gramas de H2(g) reajam completamente
com 6,0 gramas de C(s), de acordo com a reação I,
e que m2 gramas de O2(g) reajam completamente com
6,0 gramas de C(s), de acordo com a reação II. Conforme
a lei de Richter, são necessários 2 × m1 gramas de H2(g) para
reagir completamente com m2 gramas de O2(g), de acordo
com a reação III.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com a teoria da ligação de valência, nas moléculas
de metano e de água ocorre a hibridização para se formar
um orbital híbrido do tipo sp3
, o que leva as duas moléculas
a terem arranjos eletrônicos tetraédricos.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com a reação I, são necessárias mais de 24 × 1023
moléculas de H2(g) para a formação de 32,0 g de metano.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
Sendo a pólvora formada somente por salitre, enxofre e carvão,
na mesma proporção molar da reação apresentada, a queima
de 10,0 g de pólvora produzirá mais de 3,0 g de sulfeto
de potássio (K2S).
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A equação apresentada desobedece ao princípio de Lavoisier, uma vez que a massa dos produtos é menor que a massa dos reagentes devido à presença de gases de baixa densidade formados pela reação.
A equação a seguir sintetiza a reação de combustão entre o salitre, o enxofre e o carvão, substâncias presentes na pólvora.
4KNO3(s) + 7C(s) + S(s) →
3CO2(g) + 3CO(g) + 2N2(g) + K2CO3(s) + K2S(s)
Acerca desse assunto, julgue o próximo item.
A massa molar do composto formado pelo ânion do carbonato
de potássio e o cátion do nitrato de alumínio é maior que
250,0 g/mol.

A figura precedente, que apresenta os quatro elementos da natureza (fogo, ar, terra e água), encontra-se no livro De responsione mundi et astrorum ordinatione — Augsburgo, 1472 —, obra baseada nos escritos de Santo Isidoro, bispo de Sevilha durante o século VII d.C., e representa símbolos da alquimia, pela qual vários materiais foram desenvolvidos empiricamente.
A pólvora é um desses materiais, e a compreensão
do que ocorria na queima desse pó negro só aconteceu
com a evolução da química moderna.
Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Algumas vidrarias, técnicas experimentais e diversas
substâncias até hoje utilizadas são originárias da alquimia.

A figura precedente, que apresenta os quatro elementos da natureza (fogo, ar, terra e água), encontra-se no livro De responsione mundi et astrorum ordinatione — Augsburgo, 1472 —, obra baseada nos escritos de Santo Isidoro, bispo de Sevilha durante o século VII d.C., e representa símbolos da alquimia, pela qual vários materiais foram desenvolvidos empiricamente.
A pólvora é um desses materiais, e a compreensão
do que ocorria na queima desse pó negro só aconteceu
com a evolução da química moderna.
Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Na alquimia, a transformação da matéria era discutida
a partir de concepções filosóficas permeadas de misticismo.

A figura precedente, que apresenta os quatro elementos da natureza (fogo, ar, terra e água), encontra-se no livro De responsione mundi et astrorum ordinatione — Augsburgo, 1472 —, obra baseada nos escritos de Santo Isidoro, bispo de Sevilha durante o século VII d.C., e representa símbolos da alquimia, pela qual vários materiais foram desenvolvidos empiricamente.
A pólvora é um desses materiais, e a compreensão
do que ocorria na queima desse pó negro só aconteceu
com a evolução da química moderna.
Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item que se segue.
Apesar da grande contribuição da alquimia para a ciência,
as primeiras transformações químicas conduzidas pelo ser
humano aconteceram apenas com o surgimento da química
moderna.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
A partir de 18 °C, uma mistura de partes iguais em massa
de propanotriol e cicloexano se torna homogênea.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
Dado que viscosidade é a resistência que um líquido apresenta
para fluir, o propanotriol é mais viscoso que o álcool etílico.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
O nitrato de cálcio é um exemplo de sólido iônico, formado
por íons, mas que apresenta ligações covalentes na sua
estrutura.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
As ligações intermoleculares predominantes na sacarose
a 25 °C são as ligações covalentes.
Considerando os dados da tabela precedente, assim como as características e as propriedades das substâncias nela apresentadas, julgue o item a seguir.
Os sólidos moleculares são razoavelmente macios, têm
pontos de fusão baixos a moderados e apresentam baixa
condução térmica.
I. NaHCO3 II. HClO4 III. NH4OH IV. H3PO4 V. CaCl2
I. Água Deionizada. II. Água Mineral. III. Água Potável. IV. Água Destilada.
Assinale a alternativa que contenha apenas águas com grau de pureza satisfatório para a utilização no preparo de soluções aquosas.

Disponível em: <http://www2.iq.usp.br/iqrecicla/pdv 0705.html>. Acesso em: 23 jan. 2018.
( ) I indica a presença de uma substância corrosiva. ( ) II indica que há peixes mortos no local. ( ) III alerta para o risco de morte que pode ser causado pela substância. ( ) IV indica a presença de fogo.
I. Os reagentes devem ser armazenados de acordo com as suas compatibilidades para que possíveis interações entre eles não resultem em formações de gases ou em explosões. II. Para evitar a degradação e a contaminação, os reagentes líquidos (HCl, por exemplo) devem ser armazenados em locais arejados e iluminados, preferencialmente expostos ao sol. III. Nos rótulos de identificação de soluções preparadas no laboratório, devem ser evitadas informações como concentração e data de fabricação.
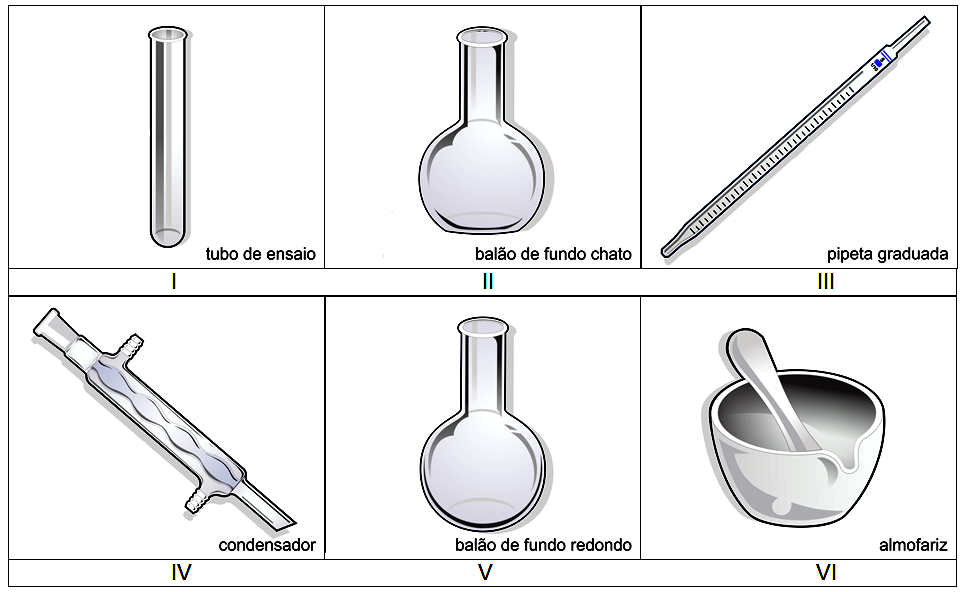 Imagem adaptada de: <http://www.vidrariadelaboratorio.com.br/vidrarias-de-laboratorio-2/>.
Acesso em: 23 jan. 2018.
Imagem adaptada de: <http://www.vidrariadelaboratorio.com.br/vidrarias-de-laboratorio-2/>.
Acesso em: 23 jan. 2018.
