Questões de Concurso Sobre química
Foram encontradas 14.093 questões

A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
H2Ind (aq) + H2O ⇄ HInd- (aq) + H3O+ (aq)
HInd- (aq) + H2O ⇄ Ind2- (aq) + H3O+ (aq)
Uma vez que as espécies com diferentes graus de
protonação apresentam cores diferentes, a coloração de uma
solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
Considerando que a fenolftaleína seja incolor em pH reduzido
e rosa em pH elevado, infere-se que a forma protonada da
fenolftaleína é a que apresenta coloração rosa.

A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
H2Ind (aq) + H2O ⇄ HInd- (aq) + H3O+ (aq)
HInd- (aq) + H2O ⇄ Ind2- (aq) + H3O+ (aq)
Uma vez que as espécies com diferentes graus de
protonação apresentam cores diferentes, a coloração de uma
solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A fórmula molecular da fenolftaleína protonada é C20H16O4.

A molécula de fenolftaleína, cuja estrutura é mostrada na figura precedente, apresenta dois hidrogênios ácidos que, conforme o pH, podem se ionizar de acordo com os equilíbrios a seguir. H2Ind, HInd- e Ind2- representam as formas protonada, monoionizada e di-ionizada da molécula, respectivamente.
H2Ind (aq) + H2O ⇄ HInd- (aq) + H3O+ (aq)
HInd- (aq) + H2O ⇄ Ind2- (aq) + H3O+ (aq)
Uma vez que as espécies com diferentes graus de
protonação apresentam cores diferentes, a coloração de uma
solução de fenolftaleína depende do pH do meio.
Tendo a figura e as informações precedentes como referência, julgue o item subsequente.
A molécula de fenolftaleína protonada apresenta as funções
fenol e éster.
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
Se, para atingir o ponto de equivalência da titulação descrita,
tiverem sido gastos 16,0 mL da solução que contenha o
excesso de NaOH, então infere-se que a concentração da
solução de H2S é igual a 9,00 × 10-2
mol/L.
Considerando essas informações e que a viragem do indicador fenolftaleína ocorra na faixa de pH entre 8,2 e 9,8, julgue o item que se segue.
No ponto de viragem da fenolftaleína, durante a titulação que envolve as soluções de NaOH e HCℓ , haverá um pequeno excesso de NaOH em relação ao HCℓ .
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução que contenha íons Cd2+ na concentração
1,0 × 10-5
mol/L, uma concentração de íons S2- igual a
1,0 × 10-20 mol/L será suficiente para iniciar a precipitação do
CdS.
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
Em uma solução aquosa de H2S, a ordem
decrescente de concentração das espécies presentes
é [H2O] > [H3O+
] > [H2S] > [S2- ] > [HS- ].
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A concentração de íons S2- em uma solução aquosa de H2S
0,100 mol/L é inferior a 1,0 × 10-10.
Considerando que as constantes de ionização ácida do H2S (Ka1 e Ka2) sejam iguais a 1,0 × 10-7 e 1,0 × 10-13, que o produto de solubilidade (Kps) do CdS seja igual a 1,0 × 10-27 e que todas as soluções envolvidas apresentem comportamento ideal, julgue o item a seguir.
A massa de H2S presente em 250 mL de uma solução aquosa
com concentração 0,100 mol/L do ácido é superior a 1,0 g.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A estrutura química da epinefrina, mostrada a seguir, dispõe de sítios capazes de interagir com seus receptores no organismo, por meio de interações químicas de Van der Waals e de ligação de hidrogênio, além de ligação iônica.
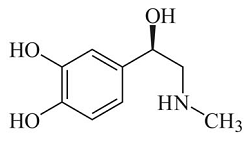
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A dissolução do gás carbônico na água para formação de água
gasosa se dá pela interação entre as moléculas de H2O e CO2,
por meio de forças intermoleculares do tipo dipolo-dipolo.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
O ponto de ebulição do etanal (CH3CHO) é maior que
o ponto de ebulição do éter dimetílico (CH3OCH3).
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
As moléculas NH3 e BH3 apresentam diferentes geometrias
moleculares.
As interações intramoleculares e intermoleculares são as responsáveis pelas várias fases (estados) da matéria e pelas propriedades físico-químicas dos materiais, além de necessárias para a determinação de estruturas de moléculas biologicamente importantes. Acerca das ligações químicas nos materiais, julgue o próximo item.
A energia de ligação entre os átomos de flúor em uma
molécula de F2 é maior que a energia de ligação entre os
átomos de nitrogênio em uma molécula de N2.

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
O ponto b indicado na figura precedente está corretamente localizado e representado pelo ponto I na curva de aquecimento seguinte.
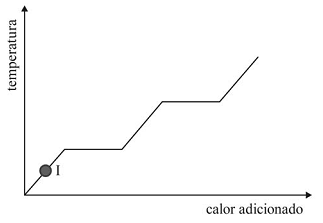

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
No ponto a da figura do diagrama de fase, as fases gasosa,
líquida e sólida coexistem.

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
A uma dada temperatura, a sublimação da substância em
questão é favorecida aumentando-se a pressão.

A figura precedente mostra um diagrama de fase para uma
substância pura que exibe três fases: sólida, líquida e gasosa.
Com base nessas informações, julgue o item subsecutivo.
O ponto c na figura representa o ponto normal de ebulição
da substância em questão.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
A substituição de 1, 2 ou 3 átomos de hidrogênio por
átomos de cloro na molécula de metano tornaria polares
todos os compostos formados, contudo, caso os 4 átomos
de hidrogênio na molécula de metano fossem substituídos
por átomos de cloro, a molécula formada seria mantida
apolar, como o próprio metano.
De acordo com a nova definição de mol recomendada pela IUPAC, um mol contém exatamente 6,02214076 × 1023 entidades elementares. Esse número é o valor numérico fixo da constante Avogadro, NA, quando expresso em mol-1 , e é chamado de número de Avogadro. A nova definição enfatiza que a quantidade de substância está relacionada com as entidades de contagem em vez da massa de uma amostra.
Internet:<https://iupac.org>
Com relação a essas informações, julgue o item que se segue.
De acordo com as leis das reações gasosas de Gay Lussac,
sob mesma temperatura e pressão, o volume ocupado
pelo CO2 é maior que o volume do O2 na reação II.