Questões de Concurso Sobre química
Foram encontradas 14.093 questões
Considere a fórmula estrutural de composto orgânico que é apresentada na figura a seguir:
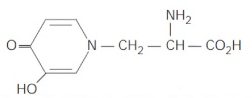
Se α e β denotam o número de átomos de carbono com hibridação sp2 e sp3, respectivamente, então α/β é igual a
A seguir são apresentadas as fórmulas estruturais das moléculas cafeína, morfina e nicotina:
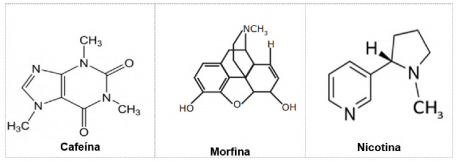
Elas apresentam em comum qual(is) função(ões) orgânica(s)?
A seguinte figura representa a estrutura molecular de uma anfetamina. Considerando a estrutura apresentada, informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir e assinale a alternativa com a sequência correta.
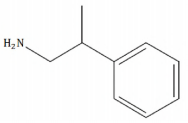
( ) O nome IUPAC da anfetamina apresentada na estrutura é 2-fenilpropan-1-amida.
( ) A anfetamina apresentada na estrutura tem fórmula molecular C9H14N.
( ) A anfetamina apresentada na estrutura apresenta um centro quiral.
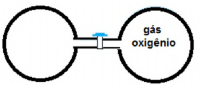
Na seguinte figura, o recipiente da esquerda tem volume V, pressão P, temperatura T e contém 84 gramas de uma gás ideal. O recipiente da direita, também de volume V, contém 96 g de gás oxigênio puro, também ideal, na pressão P e temperatura T. Com base nessas informações, o gás contido no recipiente da esquerda é o
Por que cortar cebola nos faz chorar? No momento em que cortamos esse vegetal, as células deste são quebradas e liberam enzimas denominadas alinases e, também, um grupo de compostos denominados suIfóxidos-S-alquenil cisteína. Esses compostos entram em contato com as alinases e, por meio de reações complexas, produzem o sulfóxido de tiopropanal, que é o gás causador das lágrimas.
WOLKE, R.L; O que Einstein disse ao seu cozinheiro - Mais ciência na cozinha, vol. 2, Zahar 2005. (com adaptações)
Uma das recomendações para se evitar
o sulfóxido de tiopropanal, no momento
em que se corta a cebola, é deixá-las, por
pelo menos duas horas, na geladeira,
antes de cortá-las. Isso porque, esse
procedimento acarretará
O gráfico a seguir apresenta a solubilidade de uma substância em diversas temperaturas.
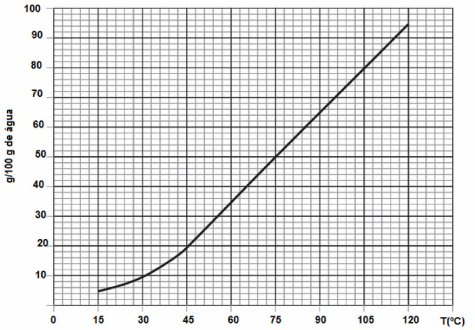
Em um bequer, 150 gramas dessa substância foram solubilizadas em 250 gramas de água, até a temperatura de 105°C. Em seguida, a solução foi resfriada em 30°C. A massa da substância,
em g, que se deposita no fundo do béquer é igual a
Uma reação em fase gasosa se propaga em duas etapas, como indicado pelo diagrama energético a seguir:
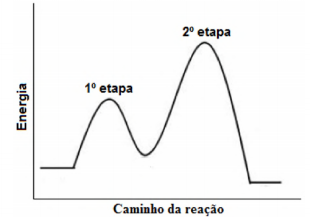
Em relação ao tema, assinale a alternativa
correta.
Considere a reação química genérica representada por x → Z , cujo gráfico da concentração de X em função do tempo é mostrada na seguinte figura.
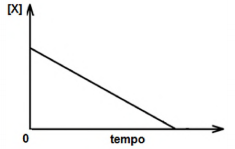
Em relação ao tema, analise as asserções a seguir:
A velocidade de consumo da substância X permanece constante durante todo o processo da reação.
PORQUE
A reação dada tem ordem global zero.
Referente às asserções, é correto
afirmar que
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A velocidade de formação de Z, em
unidades do SI, quando as concentrações
de X e Y forem iguais a 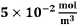 e
e 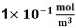 , respetivamente, é igual a
, respetivamente, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A constante de velocidade da reação,
em unidades do SI, é igual a
Três experimentos foram conduzidos, nas CNTP, objetivando investigar a cinética da reação genérica.
X + Y → Z
A tabela a seguir apresenta os resultados coletados desse experimento:

A ordem global da reação é igual a
Considere os seguintes potenciais normais de redução, de três metais genéricos X, Y e Z, respectivamente:
X2+ + 2 e- → X° E° = - 0 ,7 5 V
Y2+ + 2 e- → Y° E° = + 0 ,3 5 V
Z+ + e- → Z° E° = + 0 ,8 0 V
Assinale a alternativa que apresenta o melhor agente oxidante.
Considere a pilha ilustrada na figura a seguir, em que as soluções de ZnSO4 e CuSO4 foram empregadas com concentração inicial de 1 mol/L.
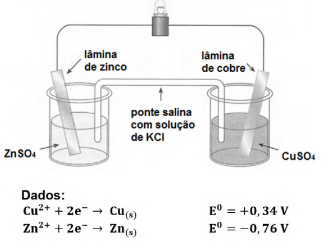
Acerca da situação apresentada, assinale a alternativa INCORRETA.
O estoque de uma companhia possuía resinas termofixas e termoplásticas. Um estagiário precisava apanhar os recipientes das duas únicas resinas termofixas que estavam nesse estoque.
Os recipientes escolhidos foram de