Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 337 questões
Considere que, em um experimento de química, um técnico misturou as soluções de três balões volumétricos em um único recipiente. Os balões tinham as seguintes especificações:
Balão A: 200 mL de NaOH 0,1 mol/L
Balão B: 100 mL de NaOH de concentração desconhecida
Balão C: 200 mL de NaOH 0,05 mol/L
Considerando o volume total da mistura é de 500 mL e que a mistura é totalmente consumida na reação química com 500 mL de ácido clorídrico (HCl) 0,1 mol/L, é correto afirmar que a concentração da solução de NaOH do balão B é igual a:
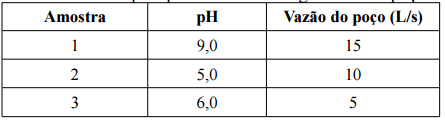
Sendo assim, o pH resultante desta mistura será:
Sabões são sais de sódio ou potássio de ácidos graxos, obtidos pela reação de gorduras e óleos (triglicerídeos) com NaOH, KOH ou Na2CO3. A reação de saponificação é representada a seguir:
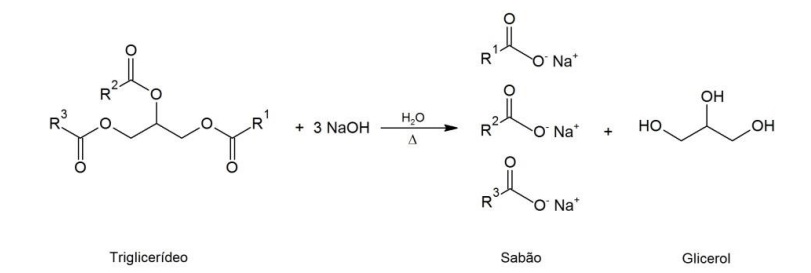
em que R1 , R2 e R3 são cadeias lineares saturadas ou insaturadas, geralmente com doze ou mais átomos de carbono.
Com base nessas informações, considere as seguintes afirmativas:
1. Uma solução aquosa de sabão puro apresenta pH < 7.
2. Adição de ácido forte a uma solução de sabão acarreta precipitação de ácidos graxos.
3. Ca(OH)2 não pode ser usado na obtenção de sabão, pois sais de cálcio de ácidos graxos são insolúveis em água.
4. A obtenção de sabão com Na2CO3 segue a mesma estequiometria que no uso do NaOH.
Assinale a alternativa correta.
Em estudo recente, pesquisadores da Embrapa mostraram que a pecuária brasileira pode ser uma arma no combate ao aquecimento global. De acordo com esse estudo, um boi emite em média cerca de 0,4 toneladas de carbono, mas seu consumo é de aproximadamente 2,5 toneladas. A 25 °C e 1 atm, qual é o volume de metano que deixa de ir (fixado pelo animal) para atmosfera?

O processo de oxidação de minérios é comumente empregado para reduzir seu teor de carbono. Desse modo, qual é a massa de oxigênio, em kg, necessária para reduzir o teor de carbono de 5% para 2% em 50 toneladas de minério?

Considere uma pessoa adulta, em repouso, com um gasto energético de 2000 kcal e consumo de 2500 kcal em um dia, na forma de alimentos. Suponha, também, que 70% do seu peso corporal de 80 kg vem da água que constitui seu corpo. Calcule a energia, em kcal, que o corpo humano teria em excesso se, além do repouso, a temperatura da água corporal aumentasse de 36,5 para 38 °C:

A equação  descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
descreve a reação entre dois
gases cuja avaliação é mencionada na tabela que se segue.
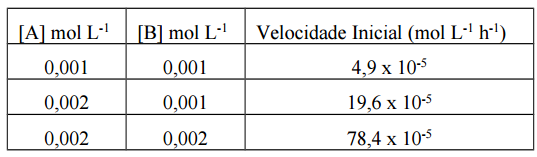
De acordo com os dados apresentados, a constante de
velocidade nessa reação, em mol-3 L3
h-1, é:
Em um experimento, para determinar a massa atômica de um elemento, foi constatado que a massa determinada era 140 vezes mais pesada do que um átomo de hidrogênio. Sabendo que o número de prótons é igual a 59, determine o número de átomos em um 1 kg de amostra desse elemento:

Considere que um frasco de quartzo de alta pressão com volume de 80 mL está inserido em um forno de micro-ondas e suponha que, dentro dele, exista apenas uma fase de vapor de água a 280 oC e 80 bar. Se essa amostra de água for resfriada até 4 oC e 1 atm, qual será o volume, em mL, de líquido?

1 N2 (g) + 3 H2 (g) → 2 NH3 (g)
Dados: Massa Molar (N2 ) = 28 kg/kmol; Massa Molar (H2 ) = 2 kg/kmol. A vazão mássica de N2 na alimentação para produção de 1700 kg/dia de amônia é
Em relação às propriedades gerais dos sólidos no estudo de soluções, julgue o item subsequente.
Quando 22,20 g de cloreto de cálcio (de fórmula CaCℓ2 e
massa molar igual a 111 g mol−1) são solubilizados em
água até formar uma solução de volume igual a 1.000 mL,
a concentração de íons cloreto na solução é
igual a 0,4 mol L−1
.
Com relação aos significados de mistura, molécula e substância, julgue o item a seguir.
Molécula é a menor porção de um composto, com um
grupo variável de átomos ligados em um arranjo mutável
e eletricamente neutro.
A química é uma ciência que explica o mundo macroscópico por meio de modelos microscópicos com uma linguagem própria que representa as substâncias e suas transformações. A esse respeito, julgue o item a seguir.
O sistema internacional de medidas utiliza apenas sete
unidades básicas, entre as quais a quantidade de matéria, cuja
unidade é o mol.
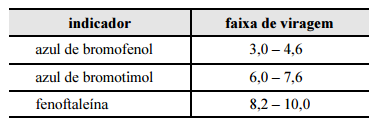
Considerando a situação descrita e a tabela apresentada, que contém faixas de viragem de diferentes indicadores, julgue o item subsequente.
Para preparar 500 mL de uma solução de HCl com concentração 0,100 mol/L, o volume V de solução estoque necessário, em mL, pode ser calculado por meio da equação a seguir, em que MHCl , C% e d representam, respectivamente, a massa molar do HCl (em g/mol), a concentração (em porcentagem massa/massa) e a densidade (em g/mL) da solução estoque.
V= [5 . MHCl / (C% . d)] . mol . %
As cores brilhantes observadas durante a queima de fogos de artifício são geradas a partir de elementos metálicos presentes nos fogos. Por exemplo, sais de estrôncio, como o SrCrO4, dão origem à luz vermelha; sais de cobre, como o Cu(NO3)2, à luz verde; sais de magnésio, como MgCl2, à luz branca.
Sabendo que esse fenômeno pode ser explicado com base na estrutura eletrônica dos diferentes elementos metálicos, julgue o próximo item.
A partir da fórmula unitária do sal cromato de estrôncio,
infere-se que a fórmula molecular do ácido crômico é HCrO4.
Hidroformilação consiste na reação de alquenos com o denominado gás de síntese (uma mistura de H2 e CO), conforme ilustrado a seguir.
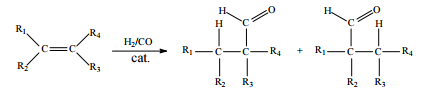
Considerando que, após a reação de hidroformilação do 1-penteno, parte dos aldeídos formados tenham sido reduzidos, in situ, aos álcoois correspondentes, julgue o item que se segue
A massa molar dos álcoois obtidos é superior a 101 g/mol.
Considere que uma amostra de biometano seja constituída exclusivamente por CH4 e CO2, com concentração de CO2 igual a 1,0% em quantidade de matéria. Nessa amostra, a concentração de CO2, em porcentagem de massa, é superior a 2,0%.
A decomposição do carbonato de cálcio é representada por:
CaCO₃ (s) → CaO (s) + CO₂ (g)
Considerando as massas molares dos elementos carbono, oxigênio e cálcio, respectivamente, iguais a 12 g mol⁻¹,16 g mol⁻¹e 40 g mol⁻¹, julgue o item a seguir.
Na decomposição completa de 50 g de carbonato de
cálcio, obtém-se um resíduo sólido de CaO de massa
igual a 28 g.