Questões de Concurso
Comentadas sobre representação das transformações químicas em química
Foram encontradas 1.177 questões
Considerando os cálculos estequiométricos e os assuntos correlatos, julgue o item a seguir.
Em uma reação química, os coeficientes
estequiométricos mostram que os átomos podem ser
criados ou destruídos em uma reação balanceada.
Usado para a limpeza de peças e ferramentas, o ácido muriático é uma solução impura de ácido clorídrico e pode ser encontrado em lojas de materiais de construção. Com o objetivo de determinar a concentração de um lote desse produto em termos de porcentagem de HCl (m/V), um químico reagiu uma alíquota de 50mL do ácido muriático comercial com carbonato de cálcio em excesso, conforme a reação:
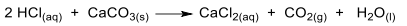
Nesse experimento, o volume coletado de CO2 foi 6,15L a 27oC e 1 atm. Qual é a porcentagem de HCl (m/V) na amostra de ácido muriático?
Massas molares (g/mol): H = 1; C = 12; O = 16; Cl = 35,5; Ca = 40

Considerando que essa reação tem um rendimento de 90%, calcule a massa de alumínio necessária para a produção de 11,2 kg de ferro para solda.
Massas molares (g/mol): O = 16; Al = 27; Fe = 56.

A reação não está balanceada. Faça o balanceamento, considerando os menores inteiros como coeficientes reacionais. A soma desses coeficientes é igual a:
Dados: densidade Hg(l) = 13,6 kg/dm3 ; massa molar Hg = 200 g/mol; considere o número de Avogadro = 6 x 1023
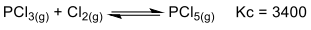
Considere que a reação acima está em equilíbrio e que as concentrações de PCl3 e Cl2 são 1,0 x 10-3 molL-1 e 1,0 x 10-2 molL-1 , respectivamente. Nessas condições, a pressão de PCl5 no equilíbrio será:
1. pesou o objeto em uma balança analítica observando uma massa igual a 57,8499 g;
2. colocou 40,0mL de água em uma proveta;
3. mergulhou o objeto na água e observou a nova marcação do volume igual a 48,1mL;
4. pesquisou as densidades desses metais na literatura especializada:
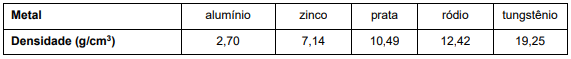
A partir desses dados, é possível concluir que o objeto é constituído de:
Massas molares em g/mol: C = 12; O = 16; Ca = 40
Uma vez que os átomos não são criados nem destruídos em uma reação, uma equação química balanceada deve ter número igual de átomos de cada lado da seta.
Em relação a medições de massa e volume, analise as assertivas abaixo:
I. A balança de laboratório deve ser mantida sobre uma superfície rígida e resistente.
II. Em caso de medições precisas de massa, as amostras que forem voláteis ou que podem adsorver água devem ser pesadas em um recipiente fechado.
III. Há diversos dispositivos para medir volumes em laboratório, tais como pipetas volumétricas, buretas e micropipetas.
IV. As vidrarias volumétricas devem ser calibradas antes da sua primeira utilização e secas em estufa.
Quais estão corretas?
A química desempenha um papel crucial no processo de reciclagem, pois permite a transformação de materiais descartados em novos produtos, contribuindo para a redução do desperdício e a preservação dos recursos naturais. Um exemplo notável é o alumínio, cuja reciclagem é economicamente viável e energeticamente eficiente devido à sua capacidade de ser fundido e remodelado repetidamente sem perder suas propriedades físicas. Além disso, a síntese do alúmen (KAl(SO4)2.12H2O) a partir do alumínio reciclado destaca-se como um processo químico relevante na reciclagem desse metal. A reação dessa síntese pode ser observada abaixo e já está estequiometricamente balanceada.
𝐴𝑙(𝑠) + 𝐾𝑂𝐻(𝑎𝑞) + 2𝐻2𝑆𝑂4(𝑎𝑞) + 11𝐻2𝑂 → 𝐾𝐴𝑙(𝑆𝑂4)2 . 12𝐻2𝑂(𝑠) + 3⁄ 2 𝐻2(𝑔)
Suponha que a preparação do alúmen partiu de 2 g de lata de alumínio. Ao final do experimento obteve-se uma massa de 10 g de alúmen seco.
Dados: H: 1 u, O: 16 u, S: 32 u; Al: 27 u; K: 39 u. A massa molar do alúmen é de 474 g/mol.
Assinale a alternativa CORRETA em que indica o rendimento mássico teórico do alúmen e seu rendimento percentual experimental, respectivamente.
É frequente a confusão que as pessoas fazem com relação ao conceito de massa específica e densidade, justamente pela similaridade conceitual entre essas duas grandezas físicas. Essa confusão pode ser justificada, em muitas das vezes, pela unidade de ambas essas grandezas serem as mesmas.
Qual das seguintes afirmações é CORRETA em relação aos conceitos de densidade e massa específica?
Leia o texto a seguir para responder às questões de 21 a 23.
Alfenas está situada no Sul de Minas, às margens do Lago de Furnas, um dos maiores lagos artificiais do Brasil. Embora o objetivo inicial da construção desse lago tenha sido a geração de energia a partir da construção de uma usina hidrelétrica, ao longo destes 60 anos as atividades turísticas e recreativas se intensificaram nessa região e não é mais possível imaginá-la sem visitantes. Contudo, recentemente uma reportagem trouxe uma preocupação para a região. Um estudo da UFMG indicou que atividades humanas como a agricultura, pecuária e lançamento do esgoto in natura podem ter afetado a qualidade da água do Lago de Furnas. Em suas análises, a pesquisadora considerou dados oficiais de monitoramento das águas em Minas Gerais relativos às bacias que alimentam o Lago de Furnas, considerando os parâmetros de turbidez, pH, densidade de cianobactérias e os níveis de E. coli.
Quando nos referimos a contaminantes inorgânicos, como cromo, mercúrio, chumbo ou cadmio, a presença destes em fontes hídricas ou até mesmo nos peixes que ocupam essas fontes é comum, dadas as atividades cotidianas ou industriais que ocorrem nos municípios ao redor. E outra atividade frequente na região de Furnas refere-se à pesca esportiva ou como fonte de renda, com criação especialmente de tilápias em tanques. Embora não tenha sido apontado no estudo, o monitoramento constante dos níveis de contaminantes, sobretudo os inorgânicos, nas águas do lago, é crucial para garantir a qualidade do peixe que chega à mesa dos mineiros e seus visitantes.
Disponível em: <https://ufmg.br/comunicacao/noticias/presenca-de-contaminantes-fecais-no-lago-de-furnas-pode-estar-acima-do-permitido> (Com adaptações). Acesso em: 17 abr. 2024.
Os níveis de contaminação são comumente expressos em diferentes unidades de concentração. Em dados ambientais, como do texto, por exemplo, é comum expressar o nível de contaminantes em ppm, que indica parte por milhão. Contudo, a IUPAC recomenda fortemente que esse termo seja abandonado, dadas as possíveis ambiguidades, e que seja substituído por unidades compatíveis com o SI, por exemplo, μmol/mol.
Assim, qual informação sobre o soluto é imprescindível para fazer a conversão (ppm para μmol/mol) em uma fração mássica?
Durante uma titulação ácido-base, 25,0 mL de uma solução de ácido clorídrico (HCl) 0,100 M é neutralizada com 35,0 mL de uma solução de hidróxido de sódio (NaOH) de concentração desconhecida. Qual é a concentração da solução de NaOH?
Um laboratorista realiza uma titulação ácido-base usando uma solução de ácido acético (CH3COOH) 0,150 M e uma solução de hidróxido de sódio (NaOH) 0,100 M. Se forem necessários 40,0 mL de NaOH para neutralizar completamente 50,0 mL de ácido acético, qual é a concentração real do ácido acético?
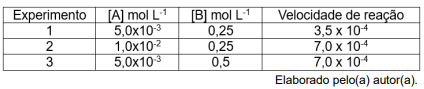
De acordo com os dados apresentados, a lei de velocidade para a reação estudada é:
Use: R = 0,082 atm . L . mol-1 K-1