Questões de Concurso
Comentadas sobre sistemas gasosos - lei, teoria cinética, equação e mistura dos gases. princípio de avogadro. em química
Foram encontradas 94 questões
Acerca dos gases, julgue o item a seguir.
A alteração de volume de uma determinada massa de um gás
provocada pela alteração de pressão a uma temperatura
constante é uma transformação isotérmica.
No processo de vaporização com a pressão constante de substâncias puras a partir do seu estado líquido, onde não há variação de temperatura, mas uma transferência de calor das vizinhanças para a substância, ocorre um efeito térmico de mudança de fases. Julgue o próximo item, relativo ao processo de efeitos térmicos que acompanham a mudança de fase de substâncias puras.
Os calores latentes de vaporização — a energia necessária
para realizar a mudança de estado líquido de uma substância
pura para o estado gasoso —, no caso dos álcoois, são
maiores que os dos alcanos acíclicos, considerando-se
cadeias com o mesmo número de átomos de carbono.
No processo de vaporização com a pressão constante de substâncias puras a partir do seu estado líquido, onde não há variação de temperatura, mas uma transferência de calor das vizinhanças para a substância, ocorre um efeito térmico de mudança de fases. Julgue o próximo item, relativo ao processo de efeitos térmicos que acompanham a mudança de fase de substâncias puras.
Existem métodos para estimar o calor latente de vaporização
de um líquido puro em qualquer temperatura a partir de um
valor conhecido em uma dada temperatura.
O estado gasoso, entre os estados de agregação, é o que permite uma descrição quantitativa simples no que tange a propriedades como quantidade de matéria, pressão, volume e temperatura.
Julgue o item a seguir acerca das propriedades dos gases.
É possível determinar a massa molar de um gás apolar
conhecendo-se apenas o volume ocupado por ele e a sua
temperatura.
O estado gasoso, entre os estados de agregação, é o que permite uma descrição quantitativa simples no que tange a propriedades como quantidade de matéria, pressão, volume e temperatura.
Julgue o item a seguir acerca das propriedades dos gases.
Em condições de pressão constante, o aumento da
temperatura de um gás ideal nas CNTP faz que o seu volume
diminua.
O estado gasoso, entre os estados de agregação, é o que permite uma descrição quantitativa simples no que tange a propriedades como quantidade de matéria, pressão, volume e temperatura.
Julgue o item a seguir acerca das propriedades dos gases.
Em condições de temperatura constante, o volume ocupado
por um gás ideal nas condições normais de temperatura e
pressão (CNTP) é inversamente proporcional à pressão a que
ele está submetido.
O estado gasoso, entre os estados de agregação, é o que permite uma descrição quantitativa simples no que tange a propriedades como quantidade de matéria, pressão, volume e temperatura.
Julgue o item a seguir acerca das propriedades dos gases.
Para um gás submetido à alta pressão (superior a 15 atm), o
fator de compressibilidade, necessariamente menor que um,
é função tanto da pressão como da temperatura.
1. 40,0 mg de Ar está confinado em um frasco de 0,0500 l a 27°C. 2. 40,0 mg de Kr está confinado em um frasco diferente de 0,0500 l a 27ºC.
A constante universal dos gases é 8,314462 L.kPa.K-1.mol-1. Massa molar aproximada: Ar = 40 g/mol, Kr = 80 g/mol.
Sobre o assunto, analise as afirmativas a seguir.
I. Para ter a mesma pressão do Ar, o Kr tem que estar a 600K. II. Para que os 2 gases tenham a mesma pressão, as temperaturas do Ar e do Kr devem ser iguais. III. O número de mol (n) do Kr é o dobro do número de mols do At.
Estão corretas as afirmativas:
Considerando essa situação, assinale a alternativa que contenha as pressões finais dos dois gases corretas.
STRATHERN, Paul. O Sonho de Mendeleiev - A verdadeira história da Química. 2002. Zahar.
Assinale a opção que apresenta corretamente a Lei de Dalton.
Essa diferença de valores pode ser explicada pelas diferenças de estrutura molecular dos dois compostos e de forças intermoleculares que atuam em cada líquido.
A esse respeito, assinale V para a afirmativa verdadeira e F para a falsa.
( ) ligações dipolo-induzido que se manifestam entre moléculas de 1-propanol são responsáveis pelo seu alto ponto de ebulição. ( ) ligações de hidrogênio mantém unidas as moléculas de metoxietano e são responsáveis pelo baixo ponto de ebulição. ( ) o ponto de ebulição do 1-propanol é maior devido à ação de forças de van der Waals.
As afirmativas são, respectivamente,
[Dados: massas molares (em g.mol-1). Metano: 16; Amônia: 17.]
Nesse caso, é correto afirmar que os recipientes contêm
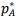 = 12 kPa e de B é
= 12 kPa e de B é 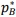 = 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta.
= 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta. A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
Um gás real comporta-se como um gás ideal quando
submetido à alta pressão e à alta temperatura.
A respeito de gases reais, de gases ideais e do modelo cinético dos gases, julgue o item.
Considerando-se que um número de moléculas n de um
gás ideal ocupe um volume de 10 m3
, a certa
temperatura e pressão, é correto afirmar que, caso a sua
pressão inicial seja reduzida pela metade e a
temperatura inicial dobre, o novo volume ocupado por
esse gás, em L, será de 4.104
.
Nessa situação, o comportamento descrito deve-se

I A pressão parcial do CO (g), a qualquer momento, será igual à pressão parcial do CH4 (g).
II A pressão total, a qualquer momento, corresponde à média entre as pressões parciais de cada gás presente no sistema.
III A pressão parcial do H2 (g) será sempre superior à do CO (g).
Assinale a opção correta.
Dados: H=1, C=12, O=16; R= 0,082 L.atm/mol.K T(K)= T(°C) + 273
