Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
I. Equilíbrios que envolvem substâncias que estão todas na mesma fase são chamados de equilíbrios homogêneos.
II. Em um sistema em equilíbrio químico, uma diminuição na pressão total sempre desloca o equilíbrio na direção que favorece a formação de mais produtos.
III. A constante de equilíbrio K de uma reação química não depende da temperatura.
Considere o equilíbrio químico abaixo:
PCl5 (g) ⇋ PCl3(g) + Cl2 (g) ΔH = 87,9 kJ
Sobre a reação acima, analise as assertivas a seguir:
I. A diminuição da temperatura desloca o equilíbrio no sentido dos produtos, favorecendo a formação de PCl3.
II. O aumento da pressão desloca o equilíbrio no sentido dos produtos.
III. A adição de um catalisador aumenta o valor da constante de equilíbrio (Kc) e acelera a reação direta e inversa.
Quais estão corretas?
Considerando um grau de equilíbrio de 60%, qual a constante de equilíbrio (Kc) durante a execução do processo Haber-Bosch?
Considere que, após o equilíbrio acima ser atingido, adicionando mais HI no reator, é correto afirmar que essa adição de HI ocasionou
Em relação à constante de equilíbrio químico em função da concentração (Kc) para um sistema químico fechado, é correto afirmar que o seu valor
● Teste de filtração: Parte do líquido passou pelo filtro, formando um filtrado transparente e um resíduo sólido.
● Teste de decantação: Após deixar a amostra em repouso por 24 horas, observou-se a formação de duas fases distintas, uma superior menos densa e outra inferior mais densa.
● Teste de condutividade elétrica: Tanto o filtrado quanto a fase inferior do líquido apresentaram condutividade elétrica.
O professor foi capaz de concluir que a amostra que seus alunos lhe forneceram era uma
( ) Em um sistema de equilíbrio químico heterogêneo, a adição de um sólido puro à reação altera a posição do equilíbrio, pois modifica a concentração das substâncias em solução ou no estado gasoso.
( ) A constante de equilíbrio K de uma reação química depende da temperatura, mas não é influenciada por mudanças na concentração dos reagentes ou produtos, nem pela adição de catalisadores.
( ) Em um sistema em equilíbrio químico, um aumento na pressão total sempre desloca o equilíbrio na direção que favorece a formação de mais produtos.
( ) Quando um sistema em equilíbrio químico sofre um aumento de temperatura, a posição do equilíbrio será deslocada no sentido da reação endotérmica, de acordo com o princípio de Le Chatelier.
A ordem correta de preenchimento dos parênteses, de cima para baixo, é:
Ao ser adicionado 6 mol de alumínio para reagir com 3 mol de gás oxigênio, em determinada condição de temperatura, para reagir em um reator de 1L, sob um rendimento reacional de 50%, o valor da constante de equilíbrio (Kc) será
N2(g) + 3H2(g) ⇌ 2NH3(g)
Considerando essas informações, avalie as proposições sobre o comportamento do sistema em equilíbrio a seguir:
I - A diminuição da pressão total favorece a formação de amoníaco (NH3).
II - A elevação da temperatura desloca o equilíbrio no sentido da decomposição do amoníaco.
III - O aumento da concentração de hidrogênio desloca o equilíbrio no sentido da formação de mais amoníaco.
IV - A adição de um catalisador aumenta a constante de equilíbrio da reação.
V - A redução da concentração de amoníaco faz com que o sistema se desloque no sentido de produzir mais amoníaco.
Com base princípio de Le Chatelier, é CORRETO concluir o que se afirma em:
Considerar a reação de síntese da amônia em fase gasosa, representada pela equação química:
N₂(g) + 3H₂(g) ⇌ 2NH₃(g)
Se inicialmente forem colocados 2 mols de N₂ e 6 mols de H₂ em um reator fechado de volume fixo de 10 L e a uma temperatura de 300 K e, após o equilíbrio ser atingido, restar 1 mol de N₂, a pressão total do sistema, assumindo comportamento ideal dos gases será de
[Dado: constante universal dos gases (R)=0,082 (atm.L)/(mol.K)]
Considere a reação química, em equilíbrio, a seguir.
Fe 3+ (aq) + 3 OH − (aq) ⇌ Fe(OH)3 (s )
Se uma quantidade de íons OH − for adicionada ao sistema em equilíbrio, o efeito dessa adição deslocará o equilíbrio para a
Uma amostra de ácido acético (CH3COOH) é dissolvida em água e estabelece-se um equilíbrio químico com seus íons correspondentes. Considere a equação química:
CH3COOH(aq) ⇌ CH3COO- (aq) + H+(aq)
Qual dos seguintes fatores afetará diretamente a posição do equilíbrio?
I. A temperatura crítica de pite é definida como a temperatura em que a corrente excede 100 microA/cm2 por 60s.
II. A temperatura crítica de pite é obtida através de técnica potenciodinâmica.
III. Em geral, o potencial crítico de pite diminui com o aumento da temperatura.
Dentre essas afirmativas, está(ão) correta(s)
Um exemplo clássico de uma reação química em
equilíbrio é a reação entre o monóxido de
nitrogênio (NO) e o dióxido de nitrogênio (NO): 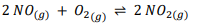
Nesta reação, o monóxido de nitrogênio (NO) reage com o oxigênio (O2) para formar dióxido de nitrogênio (NO2), e também ocorre a reação reversa, na qual o dióxido de nitrogênio (NO2) se decompõe para formar monóxido de nitrogênio (NO) e oxigênio (O2).
Assinale a alternativa que contém a equação para a constante de equilíbrio (KC) para esta reação.
Considerando a equação de equilíbrio a 160 °C
PCl5(g) ←→ PCl3(g) + Cl2(g)
Foi realizado um experimento, à mesma temperatura, e após o equilíbrio determinaram-se as seguintes concentrações:
[PCl5] = 0,027 mol.L-1
[PCl3] = 0,046 mol.L-1
[Cl2] = 0,012 mol.L-1
Desse modo, pode-se dizer que o valor da constante Kc corresponde, aproximadamente, a:
Com referência aos conceitos de equilíbrio químico, julgue o item.
Quando um sistema atinge o equilíbrio químico, as reações químicas se cessam.
No cálculo do equilíbrio químico, considera‑se as concentrações dos reagentes divididas pelas concentrações dos produtos.