Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 262 questões
[PCl5 ] 0,0456 Mol. L-1 [PCl3 ] 0,0211 Mol. L-1 [Cl2 ] 0,0121 Mol. L-1
Calcule o valor da constante de equilíbrio (em termos da concentração) em 170°C.
Os dados da literatura científica mostram que K = 54, em 700 K, para a reação:

Considere uma mistura de hidrogênio, iodo e gás iodídrico em 700 K, cujas pressões parciais dos gases sejam 10 bar, 8
bar e 1 bar, respectivamente. Sobre essa mistura reacional e os valores do quociente de reação (Q) e da constante de
equilíbrio (K), é correto afirmar que:
Os oceanos possuem a capacidade de absorver certas quantidades de CO2 atmosférico através dos equilíbrios que
formam o denominado sistema carbonato:
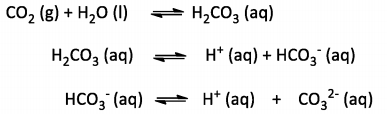
A concentração de cada espécie do sistema carbonato varia, dependendo do pH do meio. Considerando um experimento
em laboratório que simula uma condição de extrema alcalinidade (pH = 14), a espécie do sistema carbonato em maior
concentração será
Em um experimento, avaliou-se a seguinte reação química:

As concentrações iniciais de SO2 e O2 foram 0,3 mol/L e 0,2 mol/L, respectivamente. No início da reação, não havia SO3 no reator, mas atingido o equilíbrio, sua concentração foi igual a 0,2 mol/L.
Para esse sistema, a constante de equilíbrio, em termos
de concentrações, é igual a
Dentre as diversas reações para obtenção do metanol uma delas está representada abaixo:
2 H2(g) + CO(g)↔ CH3OH(g)
Sabendo que Kc vale 500 mol-2 . L2, a 27ºC, determine o valor aproximado de Kp a essa mesma temperatura:(Dado: R = 0,082 atm .L . K-1 .mol-1).
O metano tem sido empregado em várias reações, como na obtenção do gás hidrogênio, conforme equação a seguir:
CH4 (g) + H2O (g) ⇋ CO (g) + H2 (g)
Em um recipiente de 2 litros foram adicionados 4 mol de metano e 5 mol de água. Depois de certo tempo, a reação atingiu o equilíbrio e foram produzidos 6 mol de gás hidrogênio. A constante de equilíbrio (Kc) obtida será aproximadamente de:
Em relação ao equilíbrio químico no sangue, são feitas as seguintes afirmativas:
I O equilíbrio químico e os sistemas-tampão têm um papel importante no organismo humano e de outros animais.
II Nos seres humanos, o pH do plasma sanguíneo normalmente está entre 6,0 e 7,45.
III Se, por algum distúrbio, o valor do pH ficar acima de 7,8 ou abaixo de 6,8, a pessoa pode sofrer danos irreversíveis no cérebro ou até falecer.
IV Um exemplo de sistema em equilíbrio no sangue é aquele que envolve a respiração celular.
Das afirmativas acima, estão corretas apenas:
Dado: a 250°C o Kp = 1,78 atm.
Considerando a reação de formação do trióxido de enxofre no equilíbrio e sob temperatura e pressão constantes, é correto afirmar que:
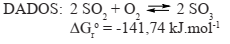
Identifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) O valor numérico da constante de equilíbrio de reações químicas sofre alteração quando há variação da temperatura da reação.
( ) A velocidade de reações químicas é alterada pela presença de catalisadores e estes (catalisadores) são totalmente consumidos durante a reação.
( ) A diminuição da temperatura de uma reação exotérmica desfavorece a formação de produtos.
( ) O tempo necessário para que a concentração do reagente se reduza a um quarto da concentração inicial é denominado de meia-vida.
( ) As leis de velocidades são determinadas experimentalmente e geralmente não podem ser escritas a partir da estequiometria da equação química da reação.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
dentifique abaixo as afirmativas verdadeiras ( V ) e as falsas ( F ).
( ) De acordo com o princípio da conservação da energia, a energia não pode ser criada nem destruída, mas somente transformada de uma espécie em outra.
( ) O estado de equilíbrio químico ocorre no momento em que o sistema reacional estaciona e a reação é completada.
( ) Aproximadamente 1,3 kW m-2 da energia radiante solar atinge a Terra, porém somente cerca de 5% desta energia é convertida em carboidratos pela fotossíntese.
( ) Denomina-se “processo exotérmico” aquele que absorve calor e apresenta ∆H > 0.
( ) Aumentar a quantidade dos reagentes é a única maneira de se elevar o valor da constante de equilíbrio de uma reação química.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Num reator em forma de balão com capacidade de 1,0 litro, numa temperatura de 100,0°C, foram adicionados 1,0 mol de H2 (g) e 1,0 mol de I2 (g).
A figura abaixo apresenta a variação das concentrações com o tempo de H2 (g), I2 (g) e de HI(g).
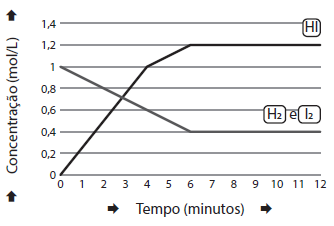
A reação é representada pela equação:
H2
(g) + I2
(g) → 2HI(g)
O valor da constante de equilíbrio é igual a:
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
As expressões da constante de equilíbrio são muito
importantes porque permitem que os químicos possam
prever a direção e a extensão de uma reação química.
Contudo, uma expressão da constante de equilíbrio não
fornece informações relacionadas à velocidade na qual
o equilíbrio é alcançado.
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
Pelo princípio de Le Chatelier, quando se exerce uma
ação sobre um sistema em equilíbrio dinâmico, ele se
desloca no sentido que produz uma minimização da ação
exercida. Em outras palavras, sempre que se aplicar um
esforço sobre um sistema em equilíbrio, a posição de
equilíbrio será alterada na direção que tende a
minimizar ou anular o efeito do esforço aplicado.
[H2]=1,83x10-3 mol/L, [l2]= 3, 12x10-3 mol/L e [HI]= 17,67 X 10-3 mol/L. 2 HI(g)
 H2(g) + I2(g)
H2(g) + I2(g)