Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 264 questões
Para a reação:
H2(g) + CO2(g) ↔ H2O(g) + CO(g)a 700°C, a constante de equilíbrio para concentrações Kc = 0,534. Calcule o número
de mols de H2(g) presentes no equilíbrio, se uma mistura de 0,300 mol de
CO(g) e 0,300 mol de H2O(g) for aquecida a 700°C em um recipiente de 10,0 L.
O metanol é preparado industrialmente a partir do gás de síntese (CO e H2), de acordo com a seguinte equação:
CO(g) + 2H2(g) ⇋ CH3OH(g) ΔHo = −21,7 kcal
Pelo princípio de Le Châtelier
Considere o texto a seguir para responder à questão.
A reação de ionização do ácido clorídrico, HCl(g) → H+(aq) + Cl-(aq) , processa-se a 25°C e 1 atm e são conhecidos os seguintes valores termodinâmicos ΔH = -75 kj/mol e ΔS = -131, 5 J/(mol. K).
Os alquenos são matéria-prima de grande importância na indústria porque podem ser facilmente transformados em uma vasta gama de compostos químicos. Exemplos típicos são as reações de hidratação e de polimerização catalisadas por ácido. Com relação às reações de alquenos, julgue o item subsequente.
A adição do catalisador ácido faz que o equilíbrio da reação
seja alcançado mais rapidamente; quando alcançado, o
equilíbrio estará mais deslocado para o sentido dos produtos.
As reações a seguir representam o sistema de tamponamento sanguíneo do bicarbonato.
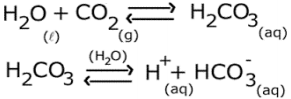
De acordo com as reações, o aumento de CO2 no sangue
resulta em
Para o sistema em equilíbrio abaixo:

são dados os valores de constante de equilíbrio, Kc, em diferentes temperaturas:
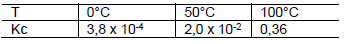
De acordo com os dados fornecidos, é correto afirmar:

Para tornar a produção de H2(g) mais eficiente, devemos:
I. As reações não vão até o fim. Elas continuam até que a composição da mistura reacional corresponda ao mínimo de entalpia. Essa composição é descrita por uma constante de equilíbrio característica da reação que depende da temperatura, dentre outros fatores. II. Para controlar o rendimento de uma reação, precisamos entender a base termodinâmica do equilíbrio e como a posição atual de equilíbrio é afetada por condições como a temperatura e a pressão, por exemplo. III. O equilíbrio químico é o estágio da reação química em que não existe mais tendência a mudar a composição da mistura da reação, isto é, as concentrações ou pressões parciais dos reagentes e produtos. Como os equilíbrios físicos, todos os equilíbrios químicos são dinâmicos, com a reação direta e inversa ocorrendo com a mesma velocidade. IV. A termodinâmica descreve quantitativamente o equilíbrio, o que nos possibilita controlar a direção e o rendimento das reações. V. A composição de uma mistura de reação no equilíbrio é descrita pela constante de equilíbrio, que é dependente do produto das atividades dos produtos (elevadas a potências iguais aos coeficientes estequiométricos da equação química balanceada da reação) dividido pelo produto das atividades dos reagentes (elevadas a potências iguais a seus coeficientes estequiométricos).
Assinale a alternativa correta:
A amônia pode ser preparada industrialmente pelo processo de Haber-Bosch, representado pela equação não balanceada a seguir.
N2(g) + H2(g) ⇌ NH3(g)
Supondo-se que a 300 ºC, esse experimento apresente concentração de N2 e de H2 de 0,3 e 2,0 mol L-1, respectivamente, e que a constante de equilíbrio Kc seja 10, a concentração de NH3, em mol L-1, nessa temperatura, deve ser, aproximadamente, de
O iodeto de hidrogênio pode ser preparado a partir do hidrogênio e do iodo moleculares na fase gasosa, conforme equação a seguir
H2(g) + I2(g) ⇋ 2HI(g)
Em um dado momento, pode-se determinar o seu quociente de reação (Qc), que representa a razão das concentrações iniciais dos produtos e dos reagentes. Nessa reação, se o valor encontrado de Qc for menor que o valor da
sua constante de equilíbrio (Kc), então,
Quando alteramos um sistema em equilíbrio, ele buscará adquirir um novo estado que anule essa perturbação. Dessa forma, há um deslocamento do equilíbrio, ou seja, uma busca por uma nova situação de equilíbrio, favorecendo um dos sentidos da reação. Se favorecer a reação direta, com formação de mais produto, dizemos que o equilíbrio se deslocou para a direita. Entretanto, é dito que se deslocou para a esquerda se foi favorecida a reação inversa, com formação de reagentes.
Esse texto refere-se á:
Assinale a alternativa CORRETA:
A formação do gás monóxido de nitrogênio (NO) a partir de gás nitrogênio (N2 ) e gás oxigênio (O2 ) fornece um exemplo prático importante das variações na constante de equilíbrio e velocidade de reação com a temperatura. Considere a equação de equilíbrio e a variação da entalpia padrão a seguir para a reação de formação do gás monóxido de nitrogênio.
½ N2(g) + ½ O2(g)  NO(g) ∆H0 = +90,4 kJ
NO(g) ∆H0 = +90,4 kJ
Sobre o equilíbrio químico envolvido no processo, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) O aumento da temperatura do sistema produz mais monóxido de nitrogênio.
( ) O aumento da temperatura diminui o valor numérico da constante de equilíbrio.
( ) A adição de NO ao sistema aumenta o valor numérico da constante de equilíbrio.
( ) A adição de O2 ao sistema produz mais monóxido de nitrogênio.
Assinale a sequência CORRETA.