Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
2HI (g)
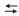 H 2(g) + I 2(g)
H 2(g) + I 2(g)O valor da constante de equilíbrio em termos de concentração (Kc ) da reação, na temperatura em questão, é
2C(grafite) + H2(g)
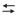 C2 H2(g)
C2 H2(g)Considere as afirmações a seguir sobre esse sistema em equilíbrio e os fatores que o influenciam.
I - A diminuição da pressão parcial do H2 no reator desloca o equilíbrio para formação do etino.
II - A adição de C ao sistema perturba o equilíbrio, deslocando a reação para o consumo de etino.
III - A retirada de etino do sistema força a formação de mais etino.
É correto APENAS o que afirma em
Considere o equilíbrio a seguir, que ocorre em um recipiente fechado.

Para deslocar o equilíbrio no sentido da produção de N2 O4 deve-se
SACAROSE C12H22O11 Constante crioscópica e ebuloscópica para água: 1,86 kg/mol e 0,51 kg/mol Densidade da água e do etanol: 1,0 g/cm³ e 0,78 g/cm³ |
FOSFATO DISSÓDICO Na2HPO4 MM = 142,0 g/mol constante do produto de solubilidade: 0,63 a 25º C FOSFATO MONOSSÓDICO NaH2PO4 ⇔ Na+ + H+ + HP4 MM = 120,0 g/mol pKa = 6,8 |
Considerando as informações fornecidas nos quadros e no gráfico acima, julgue os itens que se seguem.
A constante básica Kb da base conjugada do fosfato monossódico tem valor elevado.
Considerando-se o equilíbrio químico
NH+4(aq) + H2O(l) ⇄ H3O +(aq) + NH3(aq),
em que a constante de equilíbrio é igual a 5,6 × 10-10, é correto afirmar que o valor mais próximo para o pH de uma solução 0,15 mol/L de NH4Cl(aq) é

O processo de Haber-Bosh, que opera em altas temperaturas e altas
pressões, é bastante utilizado para a produção industrial da amônia
(NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2)
reagem exotérmica e reversivelmente para formar amônia gasosa
(NH3). No processo inverso, a reação de decomposição da amônia
em nitrogênio e hidrogênio em superfície de platina apresenta
cinética que segue comportamento conforme representado no
gráfico acima, que mostra a variação da concentração molar da
amônia gasosa [NH3] em função do tempo. Acerca dessas reações,
julgue o item a seguir.
O processo de Haber-Bosh, que opera em altas temperaturas e altas pressões, é bastante utilizado para a produção industrial da amônia (NH3). Nesse processo, os gases nitrogênio (N2) e hidrogênio (H2) reagem exotérmica e reversivelmente para formar amônia gasosa (NH3). No processo inverso, a reação de decomposição da amônia em nitrogênio e hidrogênio em superfície de platina apresenta cinética que segue comportamento conforme representado no gráfico acima, que mostra a variação da concentração molar da amônia gasosa [NH3] em função do tempo. Acerca dessas reações, julgue o item a seguir.
A adição de um gás inerte ao processo reativo de formação da
amônia — na mesma temperatura dos outros gases —
estabelecerá um novo equilíbrio químico que irá deslocar a
reação para o aumento da produção da amônia, em relação ao
equilíbrio anterior, antes da adição do gás inerte.
Nesse sentido, observa-se que
Considere a ocorrência dessa reação em um sistema no qual o equilíbrio será alcançado. Segundo o princípio de Le Chatelier, um fator que pode deslocar esse equilíbrio no sentido da diminuição da concentração de dióxido de enxofre é:

Marque a alternativa que apresenta o correto procedimento para dificultar este processo de corrosão:
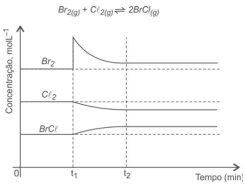
O gráfico representa a variação das concentrações de reagentes e de produto, em função do tempo, da reação química realizada no interior de um sistema fechado inicialmente em equilíbrio químico, a temperatura e volumes constantes, representado pela equação química.
A análise desse gráfico permite corretamente concluir:
O conceito de pH é muito importante para a química, principalmente na análise e correção de solos e na determinação da acidez da água de criatórios de peixes. O sucesso nessas atividades depende da determinação do pH de amostras de soluções preparadas nos laboratórios ou coletadas diretamente no campo. A mistura de 80,0mL de solução, contendo ácido clorídrico 2,50.10−1 molL−1 , com 20,0mL de uma solução de hidróxido de sódio, 5,0.10−1 molL−1 poderá resultar em uma solução final ácida ou básica, a depender das concentrações de uma ou de outra espécie química em solução.
A análise da solução final com base na determinação do pH e de suas propriedades permite corretamente concluir:
No entanto, se, em uma certa temperatura constante, esse processo alcança uma situação de equilíbrio, e o valor de constante de equilíbrio, “K”, é igual a 1, a quantidade de reagente no equilíbrio é
CaSO4 (s)
 Ca2+ (aq) + SO42-(aq) ?H > 0
Ca2+ (aq) + SO42-(aq) ?H > 0Sobre esse equilíbrio e o distúrbio causado por mudanças nas condições experimentais, tem-se que a(o)
1 -
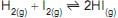
2 -
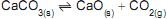
3 -

4 -
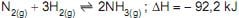
5 -
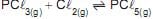
Em relação a esses sistemas, verifica-se que
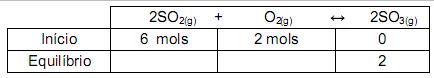
após determinação das lacunas em branco na tabela, o valor da constante de equilíbrio é
