Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Nos complexos de coordenação, os ligantes atuam como ácidos de Lewis.

Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
Considerando-se que o complexo
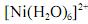 possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller.
possui comportamento paramagnético, é correto afirmar que sua geometria é tetragonal distorcida, devido à ocorrência do efeito Jahn-Teller. O equilíbrio químico é o estudo das reações químicas em que não existe mais tendência a mudar a composição da mistura de reação. O estado de equilíbrio representa uma conciliação entre duas tendências opostas: entalpia versus entropia. Assinale a alternativa correta acerca desse assunto.
É bastante comum as águas naturais serem soluções mistas, muitas vezes com capacidades tamponantes. Com relação a soluções mistas e tampões, julgue os itens abaixo como Verdadeiros (V) ou Falsos (F) e, em seguida, assinale a opção correta.
I – A adição de íons acetato em uma solução de ácido acético provocará um aumento do pH da solução.
II – A capacidade tamponante diz respeito aos diversos valores de pH a que um tampão pode ser ajustado.
III – Se o pKa de uma reação de equilíbrio entre um ácido e sua base conjugada é igual a 4,8, então um tampão formado pelo equilíbrio desse ácido com sua base conjugada poderá ser ajustado somente para valores de pH maiores que 4,8.
A sequência correta é:
A química de águas calcárias é predominantemente dominada pelo equilíbrio:
CaCO3(s) + H2O(l) ⇌ Ca+2 + HCO3- + OH- ------K
Esse equilíbrio é resultante da ocorrência de dois outros equilíbrios:
CaCO3(s) ⇌ Ca+2 + CO32- --------- KPS=4,6 × 10-9
CO32- + H2O ⇌ HCO3- + OH- -------- Kb
Considerando que a constante ácida (Ka) do HCO3- é igual a 4,7 × 10-11 e Kw é igual a 1,0 × 10-14, assinale a opção que apresenta o valor da constante de equilíbrio K.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
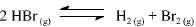
Com base nessas informações, julgue o item que se segue.
Se 0 HBr(g) for colocado em um recipiente fechado, sob
pressão inicial de 0,10 bar, e a temperatura do sistema for
elevada a 500 °C, a pressão parcial de H2(g), quando atingido o
equilíbrio, deve ser maior que 1,0 x 10-7 bar.
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
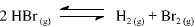
Com base nessas informações, julgue o item que se segue.
A 500 K, a constante de equilíbrio para a reação 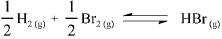 é maior que 1,0 x 104
é maior que 1,0 x 104
A constante de equilíbrio para a reação abaixo apresentada é igual a 5,3 x 10-18, a 300 K, e a 7,7 x 10-11, a 500 K.
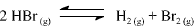
Com base nessas informações, julgue o item que se segue.
Um aumento de temperatura provoca um aumento da
velocidade da reação apresentada.
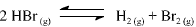
Com base nessas informações, julgue o item que se segue.
A partir dos valores da constante de equilíbrio fornecidos, é correto afirmar que a reação de decomposição do HBr(g) em H2 (g) e Br2 (g) é endotérmica.
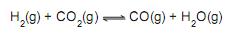
A constante de equilíbrio em termos das concentrações molares (Kc) a 750 °C para esse sistema é igual a

A uma determinada temperatura, para esse sistema, tem- se que a constante de equilíbrio, em termos das concentrações molares dos gases, Kc é igual a 5,00.10-2 . Se 40,0 g de carbonato de cálcio forem adicionados em um reator de 5,00 L, inicialmente isento de dióxido de carbono, a porcentagem de decomposição do sal, quando o equilíbrio químico for atingido, será igual a
I – É possível formar mais amônia com a pressão de 1,0 atm se a temperatura for menor que 450 K.
II – Na temperatura de 450 K e pressão de 1,0 atm, não há formação de amônia, porque o processo está em equilíbrio.
III – Com a pressão em 1,0 atm e a temperatura de 450 K, é possível formar mais amônia, utilizando um catalisador.
IV – Para formar mais amônia na temperatura de 450 K, é preciso que a pressão seja maior que 1,0 atm. /
São corretas APENAS as afirmativas
I - Em um sistema homogêneo em equilíbrio, sob pressão e temperaturas constantes, há uma razão constante entre o produto das concentrações das substâncias formadas e o das concentrações dos reagentes.
II - Em um sistema onde ocorre uma reação reversível, a pressão constante, um aumento da temperatura desloca o equilíbrio no sentido da reação que gera calor.
III - Em um sistema gasoso em equilíbrio, um aumento ou uma diminuição da pressão provocam seu deslocamento no sentido da reação que se efetua com redução ou aumento de volume, respectivamente.
IV - Em um sistema em equilíbrio, se ocorrer uma variação de um dos fatores que o afetam, o seu deslocamento ocorrerá no sentido da transformação que tende a anular ou diminuir o efeito inicial produzido.
São corretas APENAS as afirmações

I. O princípio de Le Châtelier prevê que se um sistema emequilíbrio fica sujeito a uma variação na temperatura,pressão ou concentração de um dos reagentes, o sistemamantém sua posição de equilíbrio de tal forma que o valor daconstante de equilíbrio se mantenha constante. II. A presença de um catalisador no meio reacional aumenta avelocidade na qual o equilíbrio é atingindo, sem alterar acomposição da mistura no equilíbrio. III. As variações nas concentrações ou pressões parciais provocam deslocamentos no equilíbrio sem variação no valor da constante de equilíbrio. Entretanto, o valor daconstante de equilíbrio varia à medida que a temperaturavaria. IV. A uma temperatura constante, a redução do volume de umdos reagentes em uma mistura gasosa em equilíbrio faz queo sistema se desloque no sentido dos reagentes.Quando a concentração de reagentes e produtos em um meio reacional não varia com o passar do tempo, pode-se dizer que a reação chegou a um estado de equilíbrio, em que as reações direta e inversa acontecem com a mesma velocidade. Entretanto, vários fatores podem alterar a posição de equilíbrio de uma reação. Com base nessas informações, julgue os itens a seguir
Estão certos apenas os itens:

Com base nesse processo e nos conceitos de equilíbrio químico, assinale a opção correta.

Alcoois podem ser formados a partir da reação de hidratação de alcenos catalisada por ácido. Um exemplo é a hidratação do 3,3-dimetil-1-buteno, mostrada acima.
Com relação a essa reação, julgue os itens.
