Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
Fe3O4(s)+ 4 H2(g)↔ 3 Fe(s)+ 4 H2(g) ΔH = -209,5 kcal.mol -1
e considerando as afirmações seguintes,
I. A adição de um catalisador desloca o equilíbrio para direita.
II. O aumento da pressão desloca o equilíbrio para a esquerda.
III. A diminuição da temperatura desloca o equilíbrio para a direita.
IV. A diminuição da pressão desloca o equilíbrio para a direita.
V. O aumento da temperatura desloca o equilíbrio para a esquerda.
verifica-se que está(ão) correta(s)

É(São) correta(s) apenas a(s) assertativa(s)
A constante de equilíbrio da reação entre o nitrato de prata e o cloreto de sódio, referida no texto, é menor que 1.
sistema A: Cr2O7 2- (aq) + H2O (l) ⇄2 CrO42-(aq) + 2 H+ (aq)
sistema B: 2 NO2 (g) ⇄ N2O4 (g) ΔHo = -58 kJ
Cada sistema em equilíbrio foi submetido, separadamente, a duas perturbações, descritas a seguir:
I – Foram adicionadas gotas de solução de NaOH no sistema A.
II – Foram adicionadas gotas de solução de HCl no sistema A.
III – Foi aumentada a pressão do sistema B por meio de redução de volume.
IV – O sistema B foi aquecido.
Pode-se afirmar que as cores predominantes dos sistemas A e B após as perturbações I, II, III e V, foram, respectivamente,
PCl5(g) ⇌ PCl 3(g)+ Cl 2(g)
A 250oC a referida reação apresenta Kρ = 1,8. Para que a reação apresente um fator de conversão em PCl3 e Cl2 de 30%, qual a pressão aproximada que deve ser aplicada ao sistema?
H 2(g)+ I 2(g) ⇆ 2HI (g)
O equilíbrio, nessa temperatura, foi atingido com as concentrações de H 2(g) , I 2(g)e HI(g)iguais a 0,0040 mol/L, 0,0040 mol/L e 0,028 mol/L, respectivamente.
A constante de equilíbrio, nessa temperatura, em função das concentrações em quantidade de matéria (mol/L) é igual a
H2(g)+ Cl 2(g) ⇌ 2HCl (g)
Após certo intervalo de tempo, é estabelecido o equilíbrio químico desse sistema.
Qual característica corresponde à condição de equilíbrio desse sistema químico?
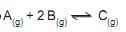 foi determinada em diferentes temperaturas, como mostra a tabela abaixo.
foi determinada em diferentes temperaturas, como mostra a tabela abaixo.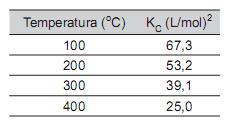
A esse respeito, considere as afirmativas a seguir
I - O aumento da temperatura aumenta a quantidade de produto formada.
II - Trata-se de uma reação com ΔH menor que zero.
III - O aumento da pressão aumenta a quantidade de produto formada.
IV - Na temperatura de 100 °C, o equilíbrio foi alcançado mais rapidamente que a 400 °C.
Estão corretas APENAS as afirmativas

Qual o valor da constante de equilíbrio, em (mol/L) -2 , para esse sistema?
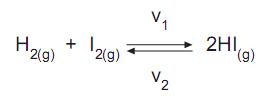
A reação química entre o iodo e o hidrogênio é uma reação reversível, que produz iodeto de hidrogênio. A velocidade de reação direta é
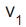 e a velocidade de reação inversa é
e a velocidade de reação inversa é 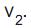 Qual a característica que se estabelece ao atingir o equilíbrio químico no sistema acima?
Qual a característica que se estabelece ao atingir o equilíbrio químico no sistema acima?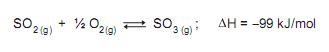
Com relação a essa reação no equilíbrio, afirma-se que o(a)
Adicionando-se cloreto de sódio na proporção de 2 mol/L de solução, qual o teor residual de prata, em mol/L, que permanecerá solúvel?
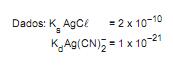

Considere as equações das seguintes reações que se encontram em condições de equilíbrio:
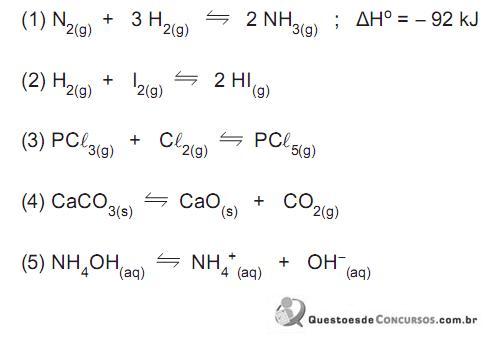
Sobre o deslocamento das reações de suas condições de equilíbrio por meio de ação externa, é INCORRETO afirmar que
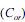 e na fase aquosa
e na fase aquosa 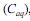 , quando atingido o
, quando atingido o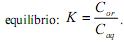
Dois estudantes realizaram a extração de um composto, a partir de uma solução aquosa com a concentração do composto igual a 0,0100 mol/L. O estudante A realizou uma única extração, utilizando 100 mL da solução aquosa e 100 mL de 1-octanol, e o estudante B utilizou o mesmo volume da solução aquosa, mas realizou duas extrações consecutivas, cada uma com 50 mL de 1-octanol.
Considerando o conjunto de informações apresentado acima e que o coeficiente de partição do composto no sistema 1-octanol/água seja igual a 2,0, julgue os itens que se seguem.
A fração do composto extraída pelo estudante B será maior que a extraída pelo estudante A.

Com base nessas informações, julgue os itens que se seguem.
Caso, na reação acima, a coloração amarela torne-se mais intensa ao se aumentar a temperatura do sistema, é correto concluir que a reação será endotérmica no sentido da formação de
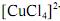 .
. 
Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
De acordo com a nomenclatura sistemática, o composto
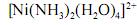 denomina-se diamintetraaquoniquelato.
denomina-se diamintetraaquoniquelato. 
Com base no conjunto de informações acima, julgue os itens que se seguem, referentes aos equilíbrios e às espécies.
A constante de equilíbrio K pode ser calculada por meio da expressão K =