Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
A amônia (NH3) é um dos produtos químicos mais importantes para o ser humano, sendo uma das cinco substâncias produzidas em maior quantidade no mundo, sendo utilizada como fertilizantes, produção de plásticos e explosivos. A equação abaixo mostra a reação de obtenção da amônia. Considerando o Princípio de Le Chatelier, identifique uma dascondições necessárias que desfavorece a produção de grandes quantidades de amônia.
N2(g) + 3 H2(g) → 2NH3(g) ∆H= - 92,22 KJ
equilíbrio ser alcançado, há 0,665 mol de CO2 no reator. O valor da constante de equilíbrio da reação, a 520°C, é aproximadamente igual a :
Os sistemas de refrigeração industrial atualmente utilizados nas indústrias de pescado, laticínios, bebidas, frigoríficos e em
outros setores econômicos baseiam-se na capacidade de algumas substâncias químicas, denominadas agentes refrige-
rantes, absorverem significativa quantidade de calor quando passam do estado líquido para o gasoso.
A amônia é um importante agente refrigerante por apresentar diversas vantagens adicionais, como, por exemplo, a de ser
natural e não agredir a camada de ozônio.
Considere 100 mL de uma solução 0,3 mol.L-1
de amônia que foram diluídos por adição de 50 mL de água destilada. Con-
sidere, também, que a constante de ionização da amônia (Kb) a 25°C é 2 x 10-5.

São dadas as seguintes semi reações:
Considere que a reação da célula é espontânea e que o sistema entra em equilíbrio.
Nessas condições, é CORRETO afirmar que a constante de equilíbrio para a reação da célula é aproximadamente igual a
Ao adicionar cloro gasoso sob pressão numa solução alcalina, o cloro se desproporciona em cloreto e hipoclorito, segundo a reação:

Dados: E0 pH 14 (V): Cl2/Cl- = 1,358; ClO- /Cl2 = 0,421; 2,303.RT/F = 0,059.
A ordem de grandeza da constante de equilíbrio da reação de desproporcionamento é:
A água pura a 25°C em equilíbrio com o ar contendo 390 ppm CO2 possui uma concentração de CO2 dissolvido próximo a 1 x 10–5 mol/L, conforme reação a seguir.
CO2 + H2O 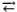 HCO3–
+ H+
HCO3–
+ H+
Considerando que a constante de equilíbrio da reação anterior é igual a 4 x 10–7, qual será o pH da água?
Considere o equilíbrio químico a seguir:
C(s) + O2
(g)  2CO (g); ∆H = – 221 kJ/mol O2(g)
2CO (g); ∆H = – 221 kJ/mol O2(g)
Para obter maior rendimento em produto, pode-se realizar
A(g)+2B(g)
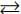 C(g),
C(g),Em relação ao deslocamento do equilíbrio é correto afirmar que:
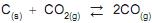
Para esse equilíbrio, a expressão da constante de equilíbrio Kc em função das concentrações das espécies, em quantidade de matéria, é:
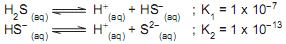
Considere as afirmações a seguir referentes a esses equilíbrios e à solução onde eles ocorrem.
I - O valor da constante de equilíbrio global do processo de ionização do H2 S é dado por K1+ K2
II - A expressão da constante de equilíbrio da primeira equação é K1 =[H+ ] [HS- ]
III - A adição de NaOH na solução diminui a concentração de H2 S na solução.
Está correto o que se afirma em
2 SO 2(g) + O 2(g) ⇌ 2 SO 3(g)
Esse comportamento segue a(o)
N2O4(g)
 NO2(g)
NO2(g) Utilizando uma seringa com a ponta fechada, na qual continha uma mistura destas substâncias em estados de equilíbrio químico, no estado físico gasoso, um estudante fez o experimento observando diferenças significativas de coloração. O experimento encontra-se esquematizado abaixo, sendo que (1) representa o estado de equilíbrio químico inicial e (2), o estado de equilíbrio químico final.
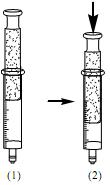
Tendo em vista o estado inicial (1) e o final (2), e que cada um destes estados apresenta uma coloração diferente em estado de equilíbrio, é correto afirmar que o estudante, ao pressionar o pistão da seringa, concluiu que
Equação de Equilíbrio da Solução 1:
2 CrO4-2 (aq) + 4 H+ (aq)
 Cr2O7 -2(aq) + 2 H2O (l)
Cr2O7 -2(aq) + 2 H2O (l) Equação de Equilíbrio da Solução 2:
[CoCl 4] -2 (aq) + 4H2O(l)
 [Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0
[Co(H2O)4Cl 2](aq) + 2 Cl-(l) ΔH<0 Com base nas informações acima, foram feitos quatro experimentos, com as duas soluções, levando-se em conta as condições para observação do deslocamento do equilíbrio químico. Os resultados foram tabelados abaixo.
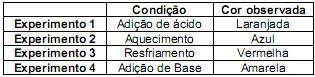
São informações corretas a respeito do estudo efetuado acima, exceto uma. Assinale a alternativa que a apresenta.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Um tanque contendo metano, a 20 ºC e a 200 atm, possui maior quantidade do gás do que a quantidade estimada com a equação dos gases ideais.
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

A constante de equilíbrio K’ para a reação abaixo, na temperatura T, é igual a (1/K) 2 .
½ CH3OH(g) ⇌ ½ CO(g) + H2(g)
CH4( g) + CO2( g) + calor ⇌ 2CO(g) + 2H2(g) (reação I)
CO(g ) + 2H2(g ) ⇌ CH3OH(g) + calor (reação II)
Na figura abaixo, são apresentadas as curvas do coeficiente de compressibilidade (Z) do metano em duas temperaturas diferentes: 20 ºC e T2.

Para a reação II, o emprego de pressões elevadas favorece a formação dos produtos tanto do ponto de vista do equilíbrio químico, quanto da cinética. Entretanto, o emprego de temperaturas elevadas favorece a formação dos produtos do ponto de vista da cinética, mas desfavorece do ponto de vista do equilíbrio