Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
Com relação à velocidade de reação química, a fatores que a influenciam e a assuntos correlatos, julgue o item
Pelo princípio de Le Chatelier, quando se exerce uma
ação sobre um sistema em equilíbrio dinâmico, ele se
desloca no sentido que produz uma minimização da ação
exercida. Em outras palavras, sempre que se aplicar um
esforço sobre um sistema em equilíbrio, a posição de
equilíbrio será alterada na direção que tende a
minimizar ou anular o efeito do esforço aplicado.
[H2]=1,83x10-3 mol/L, [l2]= 3, 12x10-3 mol/L e [HI]= 17,67 X 10-3 mol/L. 2 HI(g)
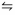 H2(g) + I2(g)
H2(g) + I2(g)Considere abaixo o equilíbrio químico.
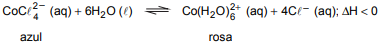
Em uma solução de cor rosa, espera-se observar a cor azul quando:
I. For adicionada solução de ácido clorídrico.
II. O sistema for aquecido.
III. Ao diluir a solução com água.
Está correto o que se afirma APENAS em
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Em meio aquoso, um ácido forte apresenta baixa tendência de transferir um próton a uma molécula de água, ou seja, a água apresenta baixa tendência de receber esse próton.
No que se refere aos ácidos e ao equilíbrio químico, julgue o próximo item.
Pelo princípio de Le Chatelier, uma perturbação em um equilíbrio químico promove um deslocamento no sentido de aumentar a perturbação promovida.
Em relação ao equilíbrio químico
2 NO(g)+ 1 O2(g) ↔ 2 NO2(g) + 27 kcal
pode-se afirmar:
Em um recipiente fechado, mantido a uma temperatura de 40°C, são inseridos os gases monóxido de carbono e gás oxigênio, cujas pressões parciais foram determinadas respectivamente em 2,1 e 1,6 atm. Observando a reação química do processo e sabendo-se que no momento que o equilíbrio químico foi atingido a pressão parcial do gás oxigênio era de 0,6 atm, podemos informar que a constante de equilíbrio Kp vale, aproximadamente:
2CO (g) + O2 (g) ↔ 2CO2 (g)
A2(g) + 3B2(g)
 2AB3(g)
2AB3(g) Considere a reação química balanceada abaixo.
2AgNO3(aq) + 2NaOH(aq)  Ag2O(s) + 2NaNO3 (aq) + H2O(l)
Ag2O(s) + 2NaNO3 (aq) + H2O(l)
A expressão da constante de equilíbrio é
Atente para a seguinte reação reversível em equilíbrio:
Considerando o quadro acima, é correto afirmar que o
valor de Kc para a reação é
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
A constante de equilíbrio da reação de decomposição de 1 mol
de H2O2, a 25 ºC, é superior a e50.
A seguir são apresentadas informações referentes à reação de decomposição do H2O2.


Considerando que a reação de decomposição do H2O2 seja exotérmica e se processe de acordo com uma cinética de primeira ordem, e que a constante universal dos gases seja igual a 8,3 J × mol-1 × K-1 , julgue o item subsequente, acerca da reação em questão.
Em temperaturas mais elevadas, o valor da constante de
equilíbrio da reação de decomposição do H2O2 é superior ao
verificado em temperaturas mais baixas.
Considere a reação ácido-base entre amônia e água mostrada a seguir:
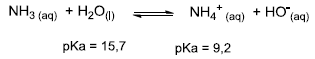
( ) A constante de basicidade da reação será Kb = [NH4+ ][HO- ]/[NH3]. ( ) A adição de NH4Cl deslocará o equilíbrio no sentido dos produtos. ( ) A água é um ácido mais fraco do que o íon amônio (NH4+ ), e o equilíbrio está deslocado no sentido dos reagentes. ( ) A amônia (NH3) é uma base mais forte do que o íon hidróxido, e o equilíbrio da reação está deslocado no sentido dos reagentes.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
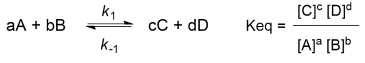
Assumindo que as equações acima são modelos que podem ser aplicados a qualquer reação química, é correto afirmar que, no equilíbrio:
1. as concentrações de A, B, C e D são iguais. 2. as concentrações de A, B, C e D não se alteram com o tempo. 3. a reação para de acontecer, logo, a formação de produtos é interrompida. 4. a constante de velocidade da reação direta (k1) é igual à da reação inversa (k-1).
Assinale a alternativa correta.
2SO3(g)
 2SO2(g) + O2(g).
2SO2(g) + O2(g).
Inicialmente a pressão parcial do trióxido de enxofre era de 1,6 bar. Ao atingir o equilíbrio foi constatada uma porcentagem de decomposição de 60%.
Se a esse sistema em equilíbrio for adicionado 1 mmol de dióxido de enxofre, mantendo-se constante as condições anteriores, quando o novo equilíbrio for atingido,
Considere um tubo selado contendo inicialmente N2O4 com pressão parcial de 0,45 atm. e temperatura constante. Após o equilíbrio ser atingido, a pressão parcial determinada para o N2O4 foi de 0,08 atm.
Com base nesses dados experimentais, o valor aproximado da constante de equilíbrio em função das pressões parciais dos gases envolvidos, é de
