Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
O dióxido de nitrogênio (NO₂ ) é uma molécula intermediária na produção industrial de ácido nítrico (HNO₃ ), que é muito aplicado na produção de fertilizantes. O dióxido de nitrogênio existe em equilíbrio com o tetróxido de nitrogênio (N₂O₄ ), segundo a reação:
2NO₂(g) ⇄ N₂O₄(g) ∆H = −57,23 kJ/mol
Para aumentar o rendimento do dióxido de
nitrogênio na reação, segundo o princípio de Le
Châtelier, deve-se:
Adaptado. Sala BioQuímica: Controle (e descontrole) do pH sanguíneo (salabioquimica.blogspot.com). Acesso em 25 de Julho de 2021.
A seguir, temos as reações de conversão do gás carbônico (CO2) em bicarbonato (HCO3 - ).
CO2 (g) + H2O (l) ↔ H2CO3 (aq) H2CO3 (aq) ↔ HCO3 – (aq) + H+ (aq)
Elas são a base para entendermos o comportamento desse sistema tamponado do sangue nos dois ambientes diferentes: no tecido muscular e nos alvéolos. Assim, de acordo com as características do controle de pH do sistema sanguíneo, assinale a alternativa correta.
CaCO3(s) ⇌ CaO(s) + CO2(g)
sabendo que cada uma das seguintes misturas (ou uma dada substância) está contida em um recipiente fechado sob determinada temperatura e em repouso.
Quanto ao equilíbrio químico e às características das soluções-tampão e das pilhas, julgue o item.
O equilíbrio químico é o estado em que duas ou mais
fases de uma mesma substância coexistem, sem que
haja tendência à mudança. Pelo princípio de Le
Chatelier, quando uma tensão ocorre nesse sistema em
equilíbrio, ele se ajusta para maximizar o efeito da
tensão, ou seja, quando o sistema em equilíbrio é sujeito
a uma perturbação, tende a aumentar o efeito
perturbador, distanciando-se da condição de equilíbrio.
Sabendo-se que a nova mistura tem constante de equilíbrio igual a 4, após o novo equilíbrio ser alcançado, a quantidade de acetato será de:
Pressurizando o sistema para 10 atm, a composição da mistura muda para:
CO (g) + CL2 (g) → COCl2 (g)
Sabendo que o grau de equilíbrio é 80%, o cálculo de Kc para esse experimento deverá apresentar o resultado aproximado de
O íon complexo [Zn(NH3)]+2 é formado a partir 3 4 da seguinte reação química:
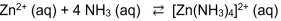
Em um experimento, ao se atingir o equilíbrio químico, as concentrações dos participantes da reação são apresentadas na tabela a seguir.
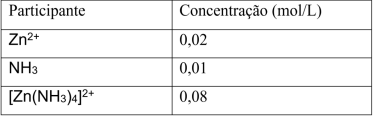
A constante de equilíbrio dessa reação é igual a:

Para melhorar o rendimento dessa síntese, duas modificações podem ser feitas sobre o sistema:
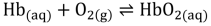
(Onde Hb é a hemoglobina e HbO é oxi- 2 hemoglobina.) O rendimento físico de um atleta está ligado, entre outros fatores, à capacidade de metabolizar oxigênio, o que pode ser prejudicado pela altitude na qual a atividade física está sendo realizada. Assim, um atleta acostumado a treinar no Rio de Janeiro (nível do mar) tem seus resultados físicos prejudicados quando compete na Cidade do México (2250 m acima do nível do mar) pois, nessa altitude, a pressão:
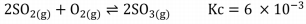
Considerando que a reação foi mantida em um recipiente de 2 L a 300K e as quantidades de dióxido de enxofre e de oxigênio no equilíbrio são 0,2 e 1,2 mols respectivamente, a concentração molar do produto obtido no equilíbrio é de:
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
Com base nessas informações, julgue o seguinte item.
A constante de equilíbrio K da reação do óxido de ferro (III) é corretamente expressa pela seguinte equação. K = [ Fe3+ ]y [ H20]z / [Fe2O3] [ H+]x
As pressões parciais iniciais de nitrogênio e hidrogênio em um vaso rígido selado são 0,020 e 0,030 bar, respectivamente. A mistura é aquecida até uma temperatura em que Kp = 0,11 para N2(g) + 3H2(g) ⇌ 2NH3(g)
Com base nisso, quais são as pressões parciais de cada substância na mistura de reação no equilíbrio?
Dada a seguinte reação, que se encontra em equilíbrio e ocorre em uma solução não saturada dos componentes, marque a opção correta.
2Fe3+ + 2S2O32− ⇌ 2Fe2++S4O62−
3 Cuo(s) + 8 HNO3(aq) → 3 Cu(NO3)2(aq) + 2 NO(g) + 4 H2O(l) (1) 2 NO(g) + O2(g) → 2 NO2(g) (2) NO2(g) ⇌ N2O4(g) (3)
Isso posto, considerando um sistema transparente e fechado, o produto NO2(g) apresenta coloração marrom. O produto N2O4(g) é um gás incolor e, quando o sistema é aquecido acima da temperatura ambiente, o sistema apresenta uma coloração marrom (forte). Em relação à equação três, referente à formação do N2O4(g), é correto afirmar que: