Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões
A formação do gás monóxido de nitrogênio (NO) a partir de gás nitrogênio (N2 ) e gás oxigênio (O2 ) fornece um exemplo prático importante das variações na constante de equilíbrio e velocidade de reação com a temperatura. Considere a equação de equilíbrio e a variação da entalpia padrão a seguir para a reação de formação do gás monóxido de nitrogênio.
½ N2(g) + ½ O2(g)  NO(g) ∆H0 = +90,4 kJ
NO(g) ∆H0 = +90,4 kJ
Sobre o equilíbrio químico envolvido no processo, assinale com V as afirmativas verdadeiras e com F as falsas.
( ) O aumento da temperatura do sistema produz mais monóxido de nitrogênio.
( ) O aumento da temperatura diminui o valor numérico da constante de equilíbrio.
( ) A adição de NO ao sistema aumenta o valor numérico da constante de equilíbrio.
( ) A adição de O2 ao sistema produz mais monóxido de nitrogênio.
Assinale a sequência CORRETA.
Sabões são sais de sódio ou potássio de ácidos graxos, obtidos pela reação de gorduras e óleos (triglicerídeos) com NaOH, KOH ou Na2CO3. A reação de saponificação é representada a seguir:
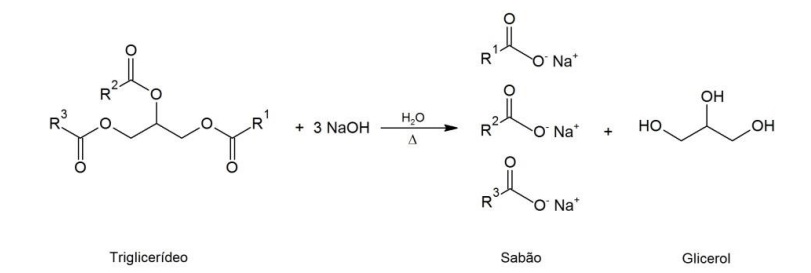
em que R1 , R2 e R3 são cadeias lineares saturadas ou insaturadas, geralmente com doze ou mais átomos de carbono.
Com base nessas informações, considere as seguintes afirmativas:
1. Uma solução aquosa de sabão puro apresenta pH < 7.
2. Adição de ácido forte a uma solução de sabão acarreta precipitação de ácidos graxos.
3. Ca(OH)2 não pode ser usado na obtenção de sabão, pois sais de cálcio de ácidos graxos são insolúveis em água.
4. A obtenção de sabão com Na2CO3 segue a mesma estequiometria que no uso do NaOH.
Assinale a alternativa correta.
O ácido fluorídrico (HF(aq.)) é utilizado na gravação de vidro, pois esse composto reage com o SiO2 segundo as seguintes reações:
SiO2(s) + 4HF(aq.) → SiF4(g) + 2H2O(l) (Equação I)
SiO2(s) + 6HF(aq.) → H2[SiF6](aq.) + 2H2O(l) (Equação II)
Devido à toxidez do SiF4(g), qual das ações a seguir poderia evitar a formação desse composto no processo descrito?
A constante de equilíbrio para a dissociação de um mol ácido monoprótico em 1 litro de água é aproximadamente 1x10-5 à temperatura de 25 ºC. Se a pressão é constante, o valor aproximado da variação na energia de Gibbs (kJ mol-1) para essa reação é de
DADOS:
Constante dos gases ideais = 8,31 J K-1 mol-1 Log10 e = 0,434
Em um recipiente, à temperatura constante, ocorre o seguinte equilíbrio, cuja reação não se encontra balanceada:

Irá provocar deslocamento do equilíbrio, no sentido da
formação de produtos, a:
Com relação à figura anterior, marque a alternativa CORRETA.
Ni2+(aq) + 3 en (aq) ↔ Ni(en)32+ (aq)
en = 1,2 etilenodiamina
Ni2+ (aq) + 6 NH3 (aq) ↔ Ni(NH3 )6 2+ (aq)
Uma das explicações para essa constatação experimental está relacionada ao:
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
Pelo princípio de Le Chatelier, quando uma força é
aplicada a um sistema em equilíbrio dinâmico, o
equilíbrio tende a se ajustar para minimizar o efeito da
força. Um exemplo disso seria o fato de que uma reação
no equilíbrio tende a seguir em uma reação endotérmica
quando se aumenta a temperatura.
Com base nos conceitos de equilíbrio químico, julgue o item subsequente.
O equilíbrio químico ocorre quando há um equilíbrio
dinâmico entre reagentes e produtos em uma reação
química, ou seja, a condição na qual os processos direto
e inverso ocorrem simultaneamente em velocidades
iguais.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A radioatividade é um fenômeno artificial inventado pelos
cientistas.
Muitas reações químicas não cessam, mas apenas entram em equilíbrio, ou seja, continuam acontecendo microscopicamente, embora não se perceba macroscopicamente. Outras reações acontecem constantemente, mas de forma muito lenta. A respeito desses fatos, julgue o item que se segue.
A relação entre as concentrações das espécies participantes de
um equilíbrio químico pode ser expressa matematicamente por
meio de uma equação que considera a concentração de cada
espécie, independentemente de seu estado físico.
Sabe-se que, a 25°C, o equilíbrio se arranja de modo a formar 0,10 mols de N2 O4 e 0,02 mols de NO2 . A 90 °C são formados 0,050 mols de N2 O4 e 0,12 mols de NO2 .
Sabendo disso, é CORRETO concluir que
A fim de testar as propriedades da água, Breno a aqueceu em uma panela e, antes de atingir seu ponto de ebulição, retirou a panela do fogo. Em seguida, ele recolheu parte dessa água com uma seringa, tapou a ponta dela e puxou o êmbolo. O que Breno observou, na sequência, foi que a água, dentro da seringa, entrou em ebulição a uma temperatura abaixo de 100 ºC.
A água entrou em ebulição com o deslocamento do êmbolo, pois este deslocamento
Atenção: Considere as informações abaixo para responder a questão.
A síntese de Haber-Bosch é o método industrial para a produção de amônia utilizada na fabricação de fertilizantes e de muitos outros compostos.
A equação global de reação é dada por:
N2(g) + 3H2(g) ⇋ 2NH3(g) ΔH = −92,22 kcal . mol−1
A tabela abaixo mostra os dados experimentais da reação de síntese da amônia realizada a temperatura e pressão constantes.

Uma mistura gasosa de 10 mmol de CO e 10 mmol de H2O é colocada em um reator de 500 mL e aquecida até 500 °C, atingindo o equilíbrio:
CO(g) + H2O(g) ⇄ CO2(g) + H2(g) com Kc = 4,00
A concentração, em mol.L–1 de dióxido de carbono nesse
equilíbrio é de
Cavernas próximas a regiões com solo rico em calcário podem formar estalactites com o passar dos anos. Sua formação pode ser representada pela equação:
CaCO3 (s) + CO2(g) + H2O (l) ⇌ Ca2+ (aq) + 2 HCO3 - (aq)
Dentre as seguintes condições:
I. Evaporação constante da água;
II. Corrente de ar frio e úmido;
III. Elevação da temperatura no interior da caverna;
IV. Visitas frequentes de grandes grupos de pessoas.
Quais favorecem a formação de estalactites?