Questões de Concurso
Sobre sistemas homogêneos: constantes: kc e kp. deslocamento do equilíbrio: fatores. em química
Foram encontradas 267 questões

Assinale a alternativa correta:
Devido à grande emissão de gases lançados na atmosfera, nas regiões mais populosas é evidente a ocorrência da chuva ácida. Na sua precipitação, um dos ácidos responsáveis pela acidez é o sulfúrico. Um equilíbrio envolvido na formação desse ácido na água da chuva está representado pela equação:
2SO2(g) + O2(g) ⇌ 2SO3(g)
Considere que são colocados 6 mol de SO2, 5 mol de O2 e 4 mol de SO3 num recipiente fechado de 5,0 L para reagirem até o sistema atingir o equilíbrio a dada temperatura. A variação do número de mol dos gases participantes está registrada no gráfico.
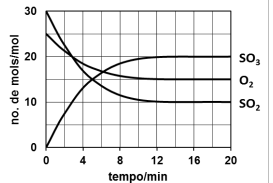
Nestas condições, a constante de equilíbrio, KC, é
igual a:
A constante de equilíbrio KC para a seguinte reação é 0,80 a uma dada temperatura. Um recipiente de 5,00L contém 0,4 mol de FeBr3, 0,5 mol de FeBr2 e 0,4 mol de Br2 nessa temperatura.
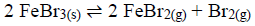
Com base no exposto, assinale a alternativa CORRETA.

De acordo com o gráfico acima e os conhecimentos sobre equilíbrio químico. Assinale a alternativa CORRETA:
Nitrogênio e Oxigênio são os gases mais abundantes da nossa atmosfera. Em temperaturas ambientes, eles reagem muito pouco, mas, nos motores dos automóveis, trabalhando em temperaturas que podem chegar a cerca de 700⁰C, a reação começa a ser favorável, tornando necessária a presença de catalisadores nos veículos como uma forma de controle da poluição atmosférica.
Observe os dados a seguir:
O valor do Kp para esta reação a 900K é de
Atenção: Para responder à questão, considere as informações abaixo.
A produção de metano no biogás através de biodigestores pode ser realizada através de digestão anaeróbia por duas classes de bactérias metanogênicas, as hidrogenotróficas e as acetoclásticas. As produções de metano por estas bactérias estão representadas pelas equações (1) e (2), respectivamente. O processo representado pela equação 2 é responsável pela produção de 70% do metano.
Dados:
R = 0,082 atm.L. K−1
4 H2(g) + CO2(g)  CH4(g) + 2H2O (l) (1)
CH4(g) + 2H2O (l) (1)
CH3COOH(l)  CH4(g) + CO2 (g) (2)
CH4(g) + CO2 (g) (2)
(Extraído e adaptado de: http://www.tcc.sc.usp.br/tce/disponiveis/18/180500/tce.../Oliveira_Rafael_Deleo_e.pdf)
A reação 2HI(g) 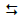 H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
H2(g) + I2(g) foi estudada por inúmeros
pesquisadores em diversas temperaturas e condições iniciais. Em
um dos estudos, a reação foi conduzida em determinada
temperatura constante e em vaso de 1,00 L, carregado
inicialmente apenas com HI. Verificou-se que, no equilíbrio,
apenas 20% do HI inicial se dissociaram. Com base nesses dados,
foi possível calcular a constante de equilíbrio da reação.
Assinale a opção que apresenta o valor correto da constante de
equilíbrio Kc.
CaCO3(s)
 CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
CaO(s) + CO2(g); ∆H = +178 kJ.mol−1
O deslocamento do equilíbrio no sentido dos produtos é mais favorecido com
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com o texto 5A3CCC, na temperatura T0, a constante de
equilíbrio para a reação 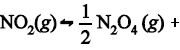 calor será igual a
calor será igual a
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
Texto 5A3CCC
Considere que, na temperatura T0, a constante de equilíbrio para a reação de decomposição do N2O4 (g) apresentada a seguir seja igual a 4,0 e que o comportamento dos gases envolvidos nessa reação seja ideal. N2O4 (g) + calor » 2NO2 (g)
De acordo com as informações do texto 5A3CCC, se, em determinado instante, na temperatura T0, as pressões parciais de N2O4 (g) e NO2 (g) dentro de uma câmara forem iguais a 0,16 bar e 0,80 bar, respectivamente, então

SO2(g) + ½O2(g) ⇋ SO3(g)
A expressão da constante de equilíbrio KC, com base na lei de ação das massas, para esta reação é
Considere que a reação química apresentada a seguir tenha ocorrido em meio aquoso, e que a velocidade dessa reação e a extensão na qual ela procede, para direita, podem ser prontamente avaliadas pela observação da cor vermelho-alaranjada do íon triiodeto I3- (os outros participantes da reação são incolores).
H3AsO4 + 3I- + 2H+ ↔ H3AsO3 + I-3 + H2O
Considerando essas informações, julgue o item subsecutivo.
A constante de equilíbrio da reação apresentada pode ser corretamente expressa como
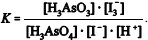
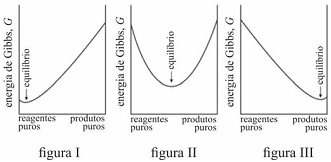
É possível prever, termodinamicamente, se os reagentes de uma mistura têm a tendência espontânea para se transformarem em produtos, se a composição, no equilíbrio, será modificada ao se alterarem as condições de um sistema, entre outros comportamentos termodinâmicos. Acerca de equilíbrio químico e considerando os gráficos representados nas figuras I, II e III, que mostram três situações de equilíbrio, julgue o item que se segue.
A reação representada no gráfico da figura II não se encontra em equilíbrio.
Com relação ao equilíbrio químico e aos fatores que o deslocam, assinale a alternativa CORRETA.
Equação 1
2C15H14O3(s) + Na2CO3(aq) ⇔ 2C15H13O3-Na+ (aq) + CO2(aq) + H2O(ℓ)
composto amarelo-claro, insolúvel em água sal de sódio do lapachol, vermelho, solúvel em água
Equação 2
C15H13O3-Na+ (aq) + HCl(aq) ⇔ C15H14O3(S) + NaCl(aq)
Através da análise das equações 1 e 2 acima é INCORRETO afirmar:
Em condições de equilíbrio a uma determinada temperatura, as pressões parciais de CO(g) e CO2(g) são 1,22 atm e 0,780 atm, respectivamente. Podemos afirmar que o valor da constante de equilíbrio para esta reação é
