Questões de Concurso
Comentadas sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.034 questões
Acerca de eletrodos de membrana de vidro, titulação potenciométrica e medida de condutividade, julgue o item subsequente.
Titulação potenciométrica é um método analítico utilizado
para determinar a concentração de uma substância em uma
solução com base na medição do potencial elétrico gerado
durante uma reação química.
Um objeto, em um recipiente contendo 10 mL de etanol e 30 mL de água, encontra-se em equilíbrio, conforme representado na figura a seguir:
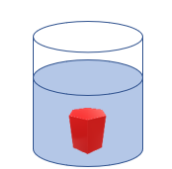
Considere que não houve contração de volume, que a água e o etanol solubilizam-se em qualquer
proporção e que as densidades da água e do etanol são, respectivamente, 1,0 g.mL-1 e 0,8 g.mL-1
.
Com essas informações, é correto afirmar que o valor aproximado da densidade do objeto será de
CaC2 O4 (s) → CaO (s) + CO (g) + CO2 (g)
Após o resfriamento, a massa de óxido de cálcio na amostra foi de 112 mg.
A concentração de íons cálcio, em g L-1 , na solução aquosa é
Dado Ca = 40 g mol-1 , C = 12 g mol-1 , O = 16 g mol-1
Ordenando-se as soluções em ordem crescente de pH, tem-se a seguinte sequência de solutos:
Diante desse cenário e com base nos dados, a concentração da solução de hidróxido de sódio, em mol L-1 , era aproximadamente
Ba+2 (aq) + Na2 SO4(aq) → BaSO4(s) + 2Na+ (aq)
O precipitado formado foi filtrado e seco.
Admitindo-se que houve completa precipitação do bário na reação e que a massa de precipitado obtido é de 9,32 g, a concentração de bário, em g L-1 , na amostra é igual a
Dado
Ba = 137 g mol-1 , Na = 23 g mol-1 , S = 32 g mol-1 , O = 16 g mol-1
Uma alíquota de 20 mL dessa solução foi completamente neutralizada por 12 mL de solução aquosa de ácido clorídrico de concentração 0,1 mol L-1 .
A massa, em gramas, de hidróxido de sódio utilizada no preparo dessa solução foi igual a
Dado NaOH = 40 g mol-1
Com base nesses dados, a quantidade de água evaporada durante o processo, em litros, equivale a
I. A mistura de 5 g de soluto em 250 mL de água destilada resultará em uma solução 2% m/V.
II. O hidróxido de magnésio, vendido em farmácias para azia, é considerado como uma solução verdadeira e homogênea.
III. O ácido clorídrico é considerado um padrão primário, implicando que sua solução não requer análises para a determinação da concentração real.
Está correto o que se afirma apenas em
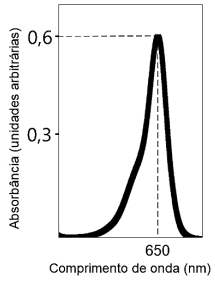
Considerando o espectro coletado e um coeficiente de absortividade molar de 40.000 L/(mol.cm) para o analito, a concentração da substância em µmol/L (micromol/L) determinada pela Lei de Lambert-Beer será de, aproximadamente:
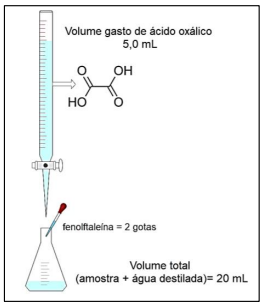
Considerando as informações fornecidas e a imagem, a concentração real da solução preparada de NaOH será de:

De acordo com essas informações, é correto afirmar que as concentrações molares dos ácidos clorídrico e nítrico são respectivamente, de

O volume do ácido sulfúrico concentrado necessário para preparar a solução solicitada pelo professor foi de, aproximadamente,
KMnO4 + H2SO4 + CH3CH2OH → K2SO4 + MnSO4 + CH3CHO + H2O + calor
A soma dos coeficientes, após o balanceamento, é de
Em relação às propriedades de substâncias e misturas, bem como aos processos de separação, julgue (C ou E) o item a seguir.
Toda mistura gasosa é uma solução.
Um estudante, em laboratório, e utilizando corretamente equipamentos de proteção individual, organizou todos os reagentes e vidrarias necessários para realizar uma titulação. Em um Erlenmeyer, ele adicionou 25 mL de uma solução de ácido oxálico, H2C2O4, que possui dois hidrogênios ionizáveis. Na bureta, o titulante por ele utilizado foi o NaOH(aq) com concentração 0,1 mol.L-1. Ao realizar, cuidadosamente, a titulação, o ponto estequiométrico foi atingido após a adição de 38 mL da solução básica. Portanto, a concentração em mol.L-1 do ácido oxálico é: