Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.244 questões
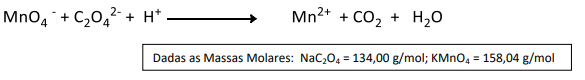
Qual é a concentração molar aproximada de solução de KMnO4?
Considere as curvas de solubilidade abaixo.
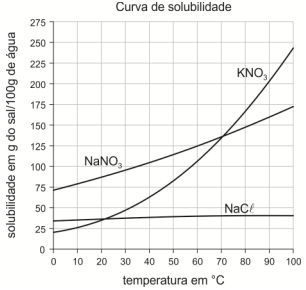
Em 100 g de água, a 20 °C, apresentará corpo de fundo uma mistura preparada com
3 C2H2O4 + 2 MnO4 − ⇌ CO3 2− + 2 MnO2 + 3 H2O + 5 CO2
Considere que, na titulação de 10 mL de uma solução de ácido oxálico pelo método descrito anteriormente, tenham sido consumidos 25 mL de uma solução de KMnO4 0,0100 mol/L. Nesse caso, a concentração em quantidade de matéria de ácido oxálico na solução-problema é de
O ácido sulfúrico puro é um líquido corrosivo e extremante solúvel em água. Para diluí-lo, basta despejá-lo em um recipiente e depois, lentamente, ir adicionando água.
Considerando os riscos de manipulação, essa afirmação está
Assinale a alternativa que contém, respectivamente, as concentrações dos íons cálcio e cloreto na solução diluída.
Assinale a alternativa que contém a resposta CORRETA.
H2 O2(aq) + 2I- (aq) → I2(aq) + 2H2 O(l)
Para tal, 1,00 mL de amostra comercial de água oxigenada foi diluída para 100,00 mL com água pura. O ponto de equivalência da titulação foi alcançado com 32,00 mL de solução do titulante.
A concentração de H2 O2 , em mol L-1 , na amostra comercial é
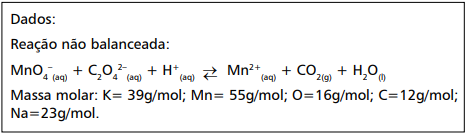
A molaridade dessa solução de KMnO4 é
HARRIS D. C. Análise Química Quantitativa. 6ª edição. Rio de Janeiro: LTC, 2005.
Durante estudo sobre erro do indicador, o analista fez uma titulação de 10,00mL de Ácido fraco (HA) 0,100mol/L (pka = 4,8) com NaOH 0,100mol/L e obteve um volume final de 9,80mL de base. O quadro abaixo apresenta três indicadores e suas faixas de viragem.
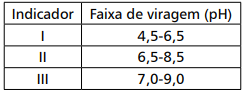
Para que o analista tenha observado esse ponto final, o(s) indicador(es) utilizado(s) foi/foram apenas
Dados: Log 49 = 1,7
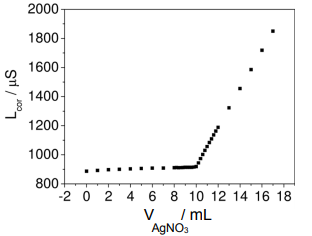
Fonte: Sartori et al (2011). Disponível em:<https://doi.org/10.1590/S0100-46702011000100008> . Acesso em: 26 fev. 2022.
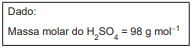
Em um laboratório, deseja-se preparar 4 L de solução aquosa de H2 SO4 com pH igual a 2 a 25ºC. Admitindo-se a ionização total de ácido, a massa de soluto, em gramas, a ser utilizada no preparo da solução é igual a

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Se a curva de titulação tivesse apenas um ponto de inflexão
negativa, então seria correto concluir que a amostra conteria
apenas NaOH.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
Ácidos fracos podem ser determinados por titulometria de
neutralização, mas não os ânions deles derivados.

A figura anterior mostra a curva de titulação de uma
amostra que pode conter NaOH, Na2CO3 e NaHCO3, em
quaisquer proporções, em que o titulante é HCl 0,100 mol/L.
Com relação a essa situação hipotética e considerando os intervalos de viragem de alguns indicadores, informados na tabela precedente, julgue o item subsequente.
A amostra em apreço contém apenas NaOH e Na2CO3.