Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.244 questões
A partir das informações precedentes, e considerando MH2O= 18 g/mol, julgue o item que se segue.
Uma emulsão é um tipo de dispersão coloidal caracterizada
por conter líquidos imiscíveis tanto na fase dispersa quanto
na fase dispersante.
I. É uma solução formada por hipoclorito de sódio, um derivado do cloro, e água. II. Para seu uso, é indicado diluir em água conforme as orientações do fabricante. III. Pode ser usada para a limpeza de alimentos.
Está(ão) CORRETO(S):
EDTA + Ca2+ → [Ca . EDTA]complexo
Sabendo que o resultado de dureza é expresso em mg/L de CaCO3, a análise físico-química da referida amostra resultará no valor de dureza total de:
(Dados: massa molar do CaCO3= 100 g/mol.)
A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

I. Em uma padronização, a concentração de uma solução é determinada pela sua titulação contra uma quantidade cuidadosamente medida de um padrão primário. II. O ponto de equivalência é um ponto na titulação, quando ocorre uma alteração física associada à condição de equivalência química. III. O padrão primário é um composto ultrapuro que serve como material de referência para os métodos titulométricos de análise. Ele deve apresentar ausência de água de hidratação e massa molar razoavelmente grande. IV. A precisão indica a proximidade da medida do valor verdadeiro, ou aceito, sendo expressa pelo erro absoluto ou erro relativo.
Está correto o que se afirma apenas em
A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

A questão abaixo se refere ao preparo e à padronização de soluções comumente utilizadas em análises químicas.
As empresas que buscam implementar a ISO 14000 têm como objetivo prover um Sistema de Gestão Ambiental (SGA) eficaz. A Figura 1 demonstra, em linha gerais, as etapas para a implantação do SGA para uma empresa:
Figura 1: Etapas para implementação do SGA com melhoria contínua.

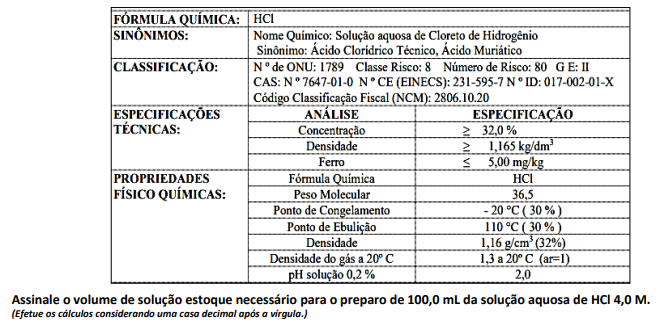
I. O processo precisa ser realizado dentro de capela de exaustão por se tratar de um ácido fixo. II. Como o processo de diluição é exotérmico, inicialmente deve-se adicionar a água e, depois, adicionar a solução estoque para minimizar o risco de acidentes. III. A solução aquosa do HCl conduz corrente elétrica uma vez que este é um composto iônico. IV. Nas condições ambientes e na ausência de água, o HCl é classificado como hidreto recebe o nome de cloreto de hidrogênio.
Está correto o que se afirma apenas em
Cr2O7 2- + 14 H+ + 6e-→ 2 Cr3+ + 7 H2O O2 + 4 H+ + 4e- → 2 H2O
Assinale, a seguir, a DQO (mg O2 /L amostra ) da amostra.
As4O6 + 6 H2O 4 H3AsO3
H3AsO3 + I3- + H2O H3AsO4 + 3 I- + 2 H+ →→
Calcule a molaridade da solução de I3¯.
Para produzir 25,0 mL de solução aquosa de ibuprofeno com concentração igual a 0,50 mol/L, é necessário usar uma massa inferior a 2,0 g desse medicamento.

Com base nessas informações, julgue o próximo item.
A função da fenolftaleína nessa titulação é tamponar a
solução.

Com base nessas informações, julgue o próximo item.
Considerando-se que 500 mg de comprimido de HAS
tenham sido dissolvidos em água e que a titulação desse
ácido com NaOH 0,100 mol/L tenha gasto 25,00 mL,
é correto concluir que a porcentagem de HAS no
comprimido é superior a 91%.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A solução de sal light é classificada como eletrolítica e a sua
condutibilidade elétrica é tão maior quanto menor for a sua
concentração.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
A concentração de íons Cl−
na solução de sal light preparada
conforme o texto é inferior a 0,05 mol/L.
A partir do texto apresentado, e considerando que as massas molares do NaCl e do KCl valham, respectivamente, 58,5 g/mol e 74,6 g/mol e que a constante de Avogadro valha 6 × 1023 mol−1, julgue o item a seguir.
Na solução de sal light preparada conforme o texto, estão
contidos 1,2 × 1022 íons de Na+
.