Questões de Concurso
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 1.248 questões
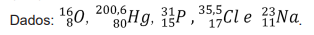
Qual o volume de solução de ácido necessário para essa neutralização?
( ) O procedimento de padronização consiste em fazer uma titulação da solução preparada, em relação a um padrão primário (ou secundário) e com base nos volumes e na massa do padrão primário (ou concentração do padrão secundário) utilizados, é possível calcular a concentração molar exata da solução.
( ) Solução padrão é uma solução na qual a concentração de um soluto é conhecida com grande confiabilidade. É uma solução de concentração exatamente conhecida, que é indispensável para realizar análises por titulação.
( ) Padrão primário é um reagente cuja pureza pode ser estabelecida por análise química e que serve como referência na titulação; deve ser bastante solúvel, ter baixo custo e massa molar pequena para minimizar o erro relativo na pesagem.
( ) Solução volumétrica é uma solução de reagentes, de concentração conhecida, destinada ao uso em determinações quantitativas como na análise volumétrica.
Assinale a alternativa que indica a sequência correta, de cima para baixo.
Qual a concentração da solução de hidróxido de potássio para neutralizar completamente o ácido?
Considere a massa molar do HNO3 igual a 63 g/mol e a massa molar do KOH igual a 56 g/mol.
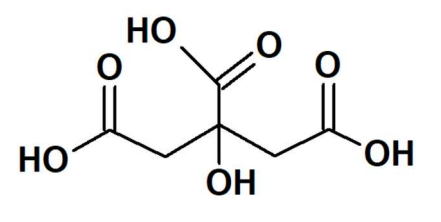
Para se determinar o teor percentual massa/volume (% m/V) em um determinado limão, coletou-se 2,0 mL do sumo deste limão e titulou-se, em triplicata, através de técnica adequada, com solução padronizada de NaOH 0,110 mol L-1 na presença de indicador fenolftaleína até atingir o ponto de equivalência. Gastou-se, em média, 12,0 mL da base. Desta forma, o valor calculado para o teor % (m/V) de ácido cítrico no limão é igual a
1 - Banho maria. 2 - Balança semianalítica.
3 - Balança analítica.
_____________________ usada para determinar a massa dos produtos e amostras.
_____________________ apresenta precisão menor que a balança analítica.
___________________ com auxílio de um termostato, regula-se a temperatura da água.
( ) O indicador alaranjado de metila no meio ácido a cor fica laranja e no meio básico a cor fica amarela com seu pH variando de 3,1 a 4,4.
( ) O indicador azul de bromotimol no meio ácido a cor fica amarela e no meio básico a cor fica azul com seu pH variando de 6,0 a 7,6.
( ) O indicador vermelho de metila no meio ácido a cor fica incolor e no meio básico a cor fica rosa com seu pH variando de 8,3 a 10,0.
( ) O funil de Büchner com diversos orifícios serve para dissolver substâncias e aquecer produtos.
( ) O balão de fundo redondo é utilizado para acolar a bomba a vácuo quando necessário.
( ) O balão volumétrico é utilizado para preparar soluções e medir com precisão um volume fixo.
O indicador recomendado para determinar o ponto final dessa titulação é o(a)
Dados: Massas molares(g.mol-1 ): Na = 23,00; S = 32,07; O = 16,00
A concentração dessa solução padrão, expressa em mg SO42- L-1 , é igual a
Considere a curva analítica.
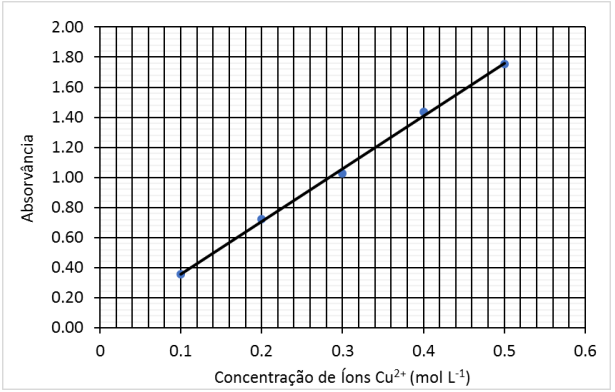
Dados: massa molar do cobre = 63,55 g.mol-1.
O teor de cobre, em % m/m, na amostra é
A equação química nesta titulação é:
B4O72- + 2 H+ + 2 H2O ➔ 4 H3BO3
Na rotina de padronização de uma solução de ácido clorídrico, 381,4 mg de bórax foram quantitativamente transferidos para Erlenmeyer, sendo dissolvidos completamente em 100mL de água. Três gotas de alaranjado de metil foram adicionados e procedeuse à titulação contra solução de HCℓ(na bureta). Na titulação, 20,0mL de solução de HCℓ foram consumidos.
A concentração da solução de HCℓ, em mol.L–1 , é, aproximadamente, igual a
O técnico deve pipetar 1,5 mL da solução padrão estoque para preparar o padrão diluído a 30 mg/L nas condições indicadas.
Para realizar o correto descarte da solução titulada citada em III, são indicados a neutralização com bases e o descarte lento na pia, sob água corrente.
Para padronizar a solução titulante citada em III, é adequado o uso do dicromato de potássio como padrão primário.