Questões de Concurso
Comentadas sobre soluções e substâncias inorgânicas em química
Foram encontradas 501 questões
− Hematita: Fe2O3; − Magnetita: FeO.Fe2O3; − Siderita: FeCO3; − Goethita: FeO(OH); e − Pirita: FeS2. É correto afirmar que
Considere o gráfico abaixo sobre a evolução da concentração de gás carbônico no ar.
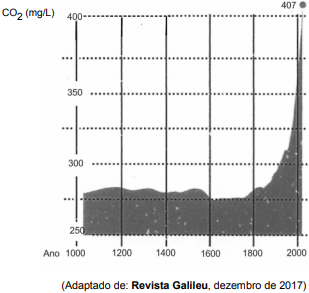
De acordo com o gráfico, do ano de 1600 até o último registro, a concentração de gás carbônico, em mol/L, passou de
Um dado importante para avaliar a qualidade da água é a determinação do índice de dureza da água, que corresponde à presença dos íons Ca2+ e Mg2+. As equações envolvidas para essa avaliação são as seguintes:
Ca2+ + H2Y2- ⇋ CaY2- + 2H+
Ca2+ + MgY2- ⇋ CaY2- + Mg2+
Mg2+ + HIn2- ⇋ MgIn- + H+
MgIn- + H2Y2- ⇋ MgY2- + HIn2- + H+
O técnico do laboratório recebeu e protocolou uma amostra de água para análise de dureza. O volume da amostra utilizado na titulação foi de 100,0 mL, e o volume de solução de EDTA 0,0100 mol L-1 gasto na titulação foi de 25,0 mL. Considere o resultado expresso em mg de CaCO3 por 1000 mL e a classificação da dureza da água, presentes na tabela abaixo.

Com base nas equações e na tabela, essa amostra é classificada como água
Com relação à titulação de neutralização de um ácido fraco monoprótico por uma base forte, considere as afirmativas abaixo.
I No ponto de equivalência, o ácido fraco remanesce sem se ionizar.
II No ponto de equivalência, o pH será sempre maior que 7.
III Na metade do volume para o ponto de equivalência, o pH é igual ao pKa do ácido fraco.
IV Após o ponto de equivalência, o pH corresponde ao de uma solução tampão.
Das afirmativas, estão corretas
Uma solução contém 100g de açúcar C12H22O11 em 500g de água a 25°C. Sendo dado que a pressão de vapor da água pura a 25°C é de 23,76 mmHg, a pressão de vapor da solução é de:
Dado: C=12.
Em uma amostra contendo 1 L de água do mar, dissolvem-se 35 g de sacarose. Em relação à consequência desse acréscimo de sacarose, são feitas as seguintes afirmações:
I. A pressão de vapor da água diminui.
II. A pressão osmótica da solução aumenta.
III. A salinidade permanece praticamente a mesma.
IV. A temperatura de solidificação é alterada.
V. O grau de dissociação dos sais presentes na água permanecerá praticamente o mesmo.
Das afirmações acima, estão corretas:
Deseja-se preparar 250 mL de solução estoque de sulfato de amônio, com concentração de 10.000 µM de N-NH4+ , para tanto, deve-se pesar:
Dados: Massas atômicas (g mol-1) N= 14,01; H= 1,01; S= 32,07 e O= 16,00.
Uma massa de 0,10 g de ácido benzoico (112 g mol-1) foi dissolvida em solvente apropriado e transferida quantitativamente para um erlenmeyer e adicionaram-se gotas de fenolftaleína. Posteriormente, adicionou-se uma solução de NaOH (40 g mol-1) de concentração desconhecida que consumiu um volume de 8,0 mL. A reação química que ocorre entre o ácido e a base está apresentada na figura que segue.
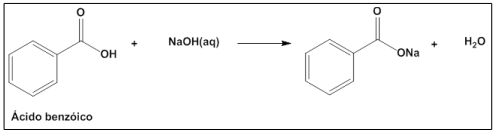
A concentração, em mol L-1, da solução de hidróxido de sódio é, aproximadamente:

Acerca dos resultados observados após a realização das misturas indicadas no quadro, julgue o seguinte item.

Acerca dos resultados observados após a realização das misturas indicadas no quadro, julgue o seguinte item.

Acerca dos resultados observados após a realização das misturas indicadas no quadro, julgue o seguinte item.