Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
Dado: massa molar da glicose anidra = 180g/mol
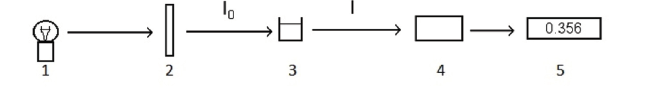
Baseado no diagrama apresentado, escolha a alternativa INCORRETA
Considere o procedimento a seguir:
Uma massa de 1,0000g de uma amostra contendo cloreto foi dissolvida e transferida quantitativamente para balão volumétrico de 100,0 mL, que teve seu volume completado com água destilada. Uma alíquota de 20,00 mL deste balão foi transferida para um erlenmeyer, ao qual adicionaram-se 30,00 mL de AgNO3 0,0500 mol L-1 para precipitar o AgCl. Após a filtração e lavagem do precipitado, com transferência quantitativa do filtrado para outro erlenmeyer, o excesso de Ag+ foi titulado com 15,00mL de NH4 SCN 0,0500mol L-1.
Em relação à determinação descrita é INCORRETO afirmar que
Tabela: solubilidade de A em água a diversas temperaturas Temperatura (°C) 10 20 30 40 50 60 Concentração de A (mg mL-1) 3 6 9 12 15 18
Analisando os dados da tabela, é CORRETO afirmar que
Quantos gramas de cloreto de sódio (NaCl) você usaria para fazer 10 L de uma solução 0,01 M?
(Considere as seguintes massas atômicas em Daltons: sódio 23, cloro 35,5).
Quantas vezes de volume de água o técnico precisa adicionar à solução estoque existente no laboratório para obter a solução desejada?
IO3– + I– + H+ ⇆ I2+ H2O (produção de iodo) I2+ S2O32– ⇆ S4O62– + I– (titulação do iodo formado)
Para a resolução desta questão, estas equações deverão ser balanceadas.
Nesse processo, cada milimol de iodato, após adicionada a solução de iodeto, consumirá
De acordo com esses dados, é CORRETO afirmar que a concentração do ácido muriático é, aproximadamente