Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
Al2(SO)3 14,3H2O + 3Ca(HCO3)2 -> 2___________ + 3CaSO4 + 6CO2 + 14,3H2O
Após análise, assinale a alternativa CORRETA que complete o enunciado acima:
Fe2O3 (s) + x H+ (aq) ⇌ y Fe3+ (aq) + z H2O (l)
Com base nessas informações, julgue o seguinte item.
O óxido de ferro (III) é um peróxido.
O suor tem temperatura de ebulição maior que a da água pura.
I. Os compostos de magnésio, principalmente seu óxido, são usados como material refratário em fornos para a produção de ferro e aço, metais não ferrosos, cristais e cimento. II. Cumprir com as normas que regulam o meio ambiente é um desafio relacionado com o controle de processos. III. O estereoisomerismo em alquenos somente é possível se os carbonos da dupla tiverem dois substituintes não idênticos. Marque a alternativa CORRETA:
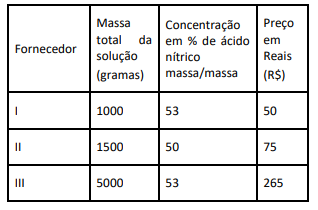
Com base nos dados da tabela, qual(is) dos fornecedores tem o menor preço por quantidade de ácido nítrico?
reação 1: HCO2H (l) + H2O (l) ⇌ H3O+ (aq) + HCO2 – (aq) reação 2: CH3NH2 (l) + H2O (l) ⇌ CH3NH3 + (aq) + OH– (aq)
A partir dessas informações, assinale a opção que apresenta os pares conjugados ácido/base para as reações 1 e 2, respectivamente, considerando a reação direta, ou seja, o reagente ácido e sua respectiva base conjugada.
A exposição à radiação ultravioleta pode causar queimadura na pele, lesão em células epiteliais, alteração do DNA, inflamação, dilatação dos vasos sanguíneos, câncer, entre outros fatores adversos. O ozônio (O3) existente na estratosfera atua como um filtro dos raios ultravioletas provenientes do Sol.
A partir dessa informação, considere que uma pessoa com massa corporal de 70 kg tenha doado sangue em um hemocentro. Sabendo-se que M (C6H12O6) = 180 g/mol, que o volume retirado de sangue correspondeu a 9 mL/kg e que o nível de glicose nesse sangue é de 0,80 mg/mL, é correto afirmar que foram doados por este paciente