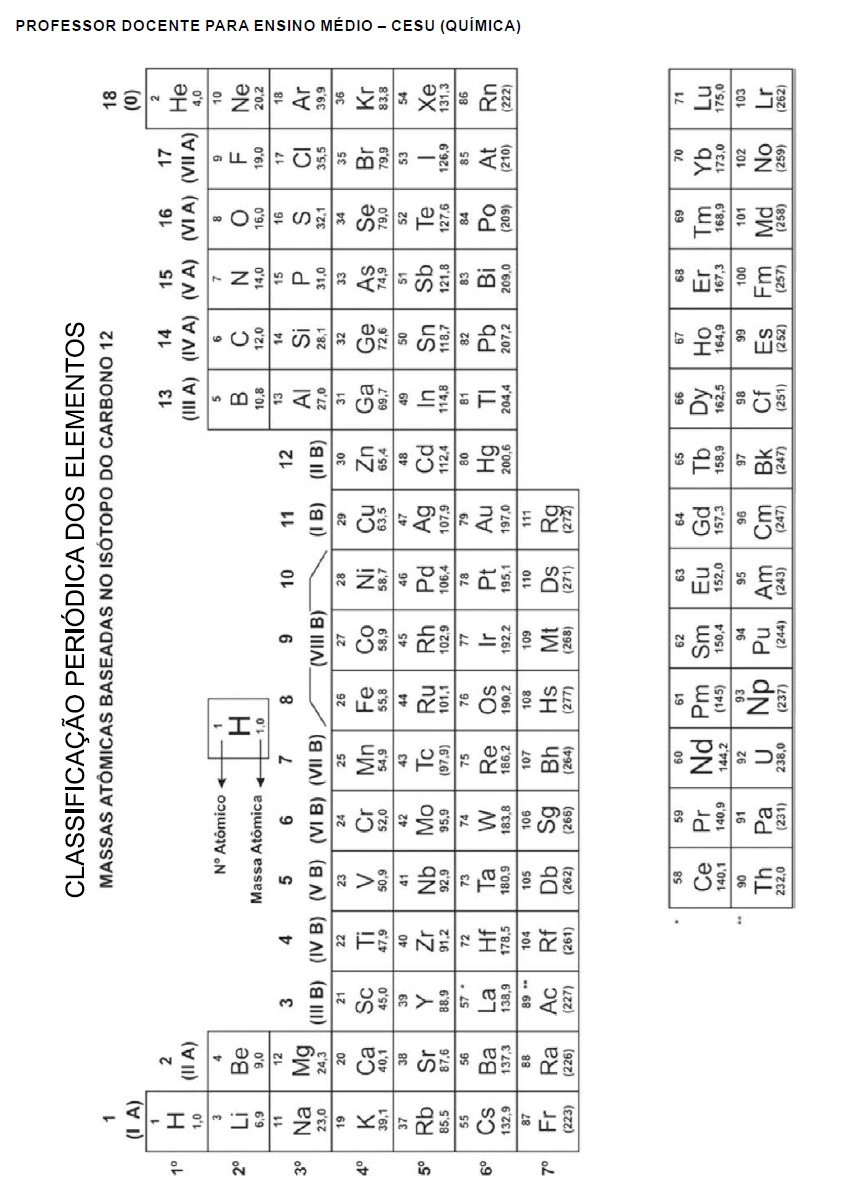
Questões de Concurso
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 2.136 questões
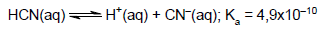
Considerando a equação que representa o equilíbrio desse ácido e sua constante de equilíbrio, conclui-se que esse ácido apresenta solução aquosa
Hcl↔H+ + Cl- (K = 1,0.10 +7)
H2SO4 ↔H+ + HSO4 - (Ka = 1,0.10 +3)
H2CO3 ↔H+ + HCO3 - (Ka = 4,3.10 -7)
I - O ácido clorídrico é o que apresenta maior ionização. II - O ácido carbônico é um ácido mais forte que o ácido sulfúrico. III- A ordem de acidez para essas substâncias é HCl > H2SO4 > H2CO3 IV - O ácido sulfúrico possui uma maior tendência em liberar íons H+ que o ácido clorídrico.
Estão corretas:
Coluna - 1 (pares de substâncias) (I) Cloreto de sódio e glicose (II) Naftaleno e sacarose (III) Nitrato de sódio e bicarbonato de sódio
Coluna - 2 (testes) (X) pH de suas soluções aquosas (Y) Dissolução em água (Z) Condutividade de suas soluções aquosas
Quais os testes (Coluna - 2) devem ser usados para distinguir os pares de substâncias em I, II e III, (Coluna - 1), respectivamente.
Dados: massas molares em g.mol-1 : C = 12; O = 16. Volume molar dos gases a 1 atm e 30°C = 25 L.mol-1 . Solubilidade do CO2(g) no refrigerante a 5°C e sob 1 atm de CO2(g) = 3,0 g.L-1 .
Em uma batida de trânsito, a dosagem de álcool no sangue de um indivíduo mostrou o valor de 0,080 g por 100 mL de sangue. Supondo que o volume total de sangue desse indivíduo seja 6,0 L, e admitindo que 12% do álcool ingerido se encontra no seu sangue, quantas doses de bebida alcoólica ele deve ter tomado?
Dados: 1 dose de bebida alcoólica = 20 g. Porcentagem em gramas de etanol na bebida 40%.
Dados: Massas molares em g . mol−1 : O = 16; K = 39; Cr = 52.
Um estudante misturou, acidentalmente, dois frascos de solução aquosas básicas, uma de 300 mL de hidróxido de sódio 0,2 mol/L e outra de 100 mL de hidróxido de potássio.
Considerando que a concentração de íons hidróxidos na mistura foi de 0,3 mol/L, é correto afirmar que a razão entre as concentrações, em mol por litro, dos íons K+ e Na+ após a mistura é igual a
Considerando que a viragem ocorreu após consumir 20 mL do ácido, em porcentagem, qual é o grau de pureza aproximado do hidróxido de sódio?
Um comerciante de reagentes químicos fornece ácido clorídrico concentrado em cujo rótulo consta que contém 37,50% em massa de HCl (massa molar = 36,5 g.mol–1) e que sua densidade é de d=1,205 g.cm–3.
Calcule o volume necessário desse ácido que deve ser usado para preparar 10,0 L de HCl(aq) de concentração final de 0,7436 mol.L–1.
Devido à sua isotonicidade em relação ao sangue humano, o soro fisiológico é normalmente usado para infusão intravenosa.
Calcule, respectivamente, a massa necessária de cloreto de sódio, NaCl, (58,50 g.mol–1) para preparar 5,0 L de soro fisiológico que tenha uma concentração de 0,90% (massa/massa) e a concentração molar dessa solução
Há diversas formas de expressar concentração de reagentes em solução ou misturas.
Relacione corretamente as colunas 1 e 2 abaixo.
Coluna 1 Nomenclatura
1. molalidade
2. molaridade
3. fração molar
4. porcentagem massa/massa
Coluna 2 Definições
( ) Relação entre o número de mol do soluto e o volume da solução em litros.
( ) Quociente entre o número de mol do soluto e o número de mol total da solução.
( ) Quociente entre a massa do soluto em gramas e a massa da solução em gramas multiplicado por 100%.
( ) Relação do número de mols do soluto e a massa do solvente em quilogramas.
Assinale a alternativa que indica a sequência correta, de cima para baixo.