Questões de Concurso
Sobre substâncias e suas propriedades em química
Foram encontradas 1.458 questões
Com base nas informações, tem-se que o(a)
Toda ligação química covalente formada entre dois átomos de diferentes elementos apresenta momento dipolar diferente de zero, o que implica que a espécie molecular relacionada apresenta momento dipolar diferente de zero.
O modelo de hibridização é fundamental para explicar a formação de compostos que apresentam ligações iônicas.
A formação ou rompimento de ligação covalente é sempre um processo endotérmico.
A maior parte dos sólidos covalentes é de materiais amorfos, os quais apresentam unidades estruturais dispostas de forma desordenada.
Um dos estudantes, de forma inadvertida, inverteu os volumes de hexano e acetato de etila e acabou por preparar, após a adição da sílica, uma mistura homogênea.
Considerando a situação hipotética descrita acima, julgue o item.
Dois líquidos miscíveis podem ser separados pelo procedimento de decantação, que consiste no aquecimento até a temperatura de ebulição de um deles.
Um dos estudantes, de forma inadvertida, inverteu os volumes de hexano e acetato de etila e acabou por preparar, após a adição da sílica, uma mistura homogênea.
Considerando a situação hipotética descrita acima, julgue o item.
É correta a utilização da técnica de destilação para se separar o hexano do acetato de etila na mistura homogênea preparada pelo estudante.
Um dos estudantes, de forma inadvertida, inverteu os volumes de hexano e acetato de etila e acabou por preparar, após a adição da sílica, uma mistura homogênea.
Considerando a situação hipotética descrita acima, julgue o item.
As quantidades que o estudante utilizou erroneamente foram 900 mL de acetato de etila e 100 mL de hexano.
Um dos estudantes, de forma inadvertida, inverteu os volumes de hexano e acetato de etila e acabou por preparar, após a adição da sílica, uma mistura homogênea.
Considerando a situação hipotética descrita acima, julgue o item.
A mistura heterogênea preparada erroneamente pelo estudante é uma solução.
Um dos estudantes, de forma inadvertida, inverteu os volumes de hexano e acetato de etila e acabou por preparar, após a adição da sílica, uma mistura homogênea.
Considerando a situação hipotética descrita acima, julgue o item.
A mistura homogênea que deveria ter sido preparada pode ser corretamente classificada como uma suspensão.
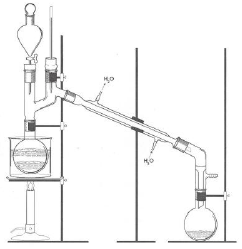
Para se realizar uma destilação azeotrópica, está correta a montagem na qual se conecta a vidraria mostrada em A à mostrada em G, sendo esta última, por fim, conectada à vidraria mostrada em D.
1. A massa específica da água depende da pressão e da temperatura.
2. A partir de 0 °C, a massa específica da água cresce até atingir seu máximo valor a 15 °C, ponto a partir do qual passa a diminuir.
3. O peso específico da água é a relação entre o peso da água e sua pressão.
Assinale a alternativa correta.
A reação abaixo representa a formação do íon acílio, por meio da ação do catalisador A1C13, durante uma reação de acilação de Fiedel-Crafts (etapa 1 da rota de Boots apresentada no texto).

A respeito do mecanismo apresentado e das espécies envolvidas, julgue o item subsequente.
O A1C13 apresenta três ligações covalentes polares e a
molécula, como um todo, é apoiar.
Visando adequar-se aos conceitos de síntese limpa, a indústria química tem procurado substituir antigas rotas sintéticas por outras que possibilitem minimizar a geração de resíduos e os riscos ambientais a eles associados. Um exemplo disso é o processo industrial desenvolvido para a síntese do analgésico ibuprofeno, da Hoechst-Celanese, a partir do composto X representado no esquema da figura a seguir. Esse processo é com posto de três etapas, apresenta reduzido emprego de solventes e resulta em uma utilização atômica de cerca de 77%. Tal processo representou considerável avanço em relação à rota clássica, da companhia Boots, também mostrado na figura, que possui 6 etapas e uma pobre utilização atômica, além de requerer o uso de elevadas quantidades de solvente e provocar geração de sais residuais.

Considerando as rotas sintéticas apresentadas no texto, suas reações e com postos envolvidos, julgue os itens de 89 a 103.
No com posto A5 é possível identificar átomos de carbono com
as ligações orientadas segundo os vértices de um tetraedro, de
um triângulo e, também, orientadas a 180° (linearmente).
Considere as seguintes entalpias padrões, 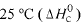
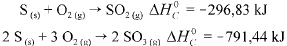
Com base nessas informações, julgue o item que se segue.
A molécula de SO2 é apoiar, enquanto a de SO3 é polar
Um químico desejava preparar 500 mL de uma solução de hidróxido de amônio (NH4OH) 0,10 mol/L pela diluição de uma solução estoque de NH4OH que, segundo o rótulo do frasco, apresenta concentração 30% em m assa e densidade 0,895 g/mL. Com base nesses dados, o químico realizou o cálculo do volume da solução estoque a ser em pregado e preparou a solução. Como a amônia é um a substância altamente volátil, o químico julgou conveniente aferir a concentração da solução resultante realizando a titulação de 20,0 mL dessa solução com uma solução padrão de HC1 0,090 mol/L.
Considerando que, a 25 °C, a constante de basicidade do NH4OH é igual a 1,8 x 10 5 e a constante de autoprotólise da água, definida como o produto das atividades dos íons hidróxido e hidrônio, é igual a 1,0 x 10-14 , e atribuindo comportamento ideal para todas as soluções envolvidas, julgue o item seguinte, tendo o texto apresentado como referência.
A polaridade da ligação H— X, em que X corresponde a um
halogênio, é maior no HC1 que no HBr.
