Questões de Concurso
Comentadas sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 228 questões
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
C2H4(g) + 6 F2(g) → 2 CF4(g) + 4 HF(g)
A partir das entalpias de formação (∆Hof) abaixo:
H2(g) + F2(g) → 2 HF(g) ∆Hof = - 537,6 kJ C(s) + 2 F2(g) → CF4(g) ∆Hof = - 680 kJ 2 C(s) + 2 H2(g) → C2H4(g) ∆Hof = + 52,3 kJ
BROWN, T. L.; LEMAY JR., H. E.; BURSTEN, B. E. Química, a Ciência Central. Tradutor Robson Matos, São Paulo: Pearson Prentice Hall, 2005, 5ª impressão em 2010.
Marque a alternativa que corresponde ao valor de variação de entalpia (∆Hor ) da reação do etileno com o gás flúor.
No calorímetro da figura abaixo, que opera em volume constante, 1000 moléculas de glicose foram queimadas.
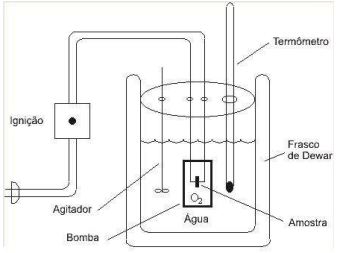
Figura: Bomba Calorimétrica. https://www.ebah.com.br/content/ABAAABOZIAG/bomba-calorimetrica
O calor do processo foi da ordem de 6397,5 KJ em temperatura igual a 25 °C. Dados: R = 8,314 JK-Mol- A variação de entalpia nesta reação foi igual a
Dados das massas molares em g.mol-1 : C = 12 e O = 16.
Observe o diagrama de energia a seguir.
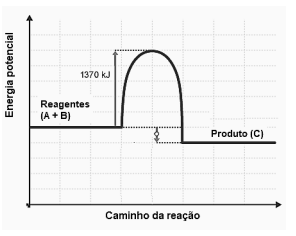
O diagrama se refere a uma reação do tipo
1 C4H10(g) + 6.5 O2(g) → 4 CO2(g) + 5 H2O(g)
Analisando a equação acima balanceada adequadamente e os dados de entalpiaspadrão de formação de cada um dos seus componentes (abaixo), assinale a alternativa que apresenta qual será o valor de ∆H (calor de reação), em Kcal, para a queima completa do butano Dados: entalpias-padrão de formação para 1mol da substância: 4 C(s) + 5 H2(g) → 1C4H10(g) ∆H = -125 Kcal; 1 C(s) + 1O2(g) → 1CO2(g) ∆H = -394 Kcal e 1 H2(g) + 0.5 O2(g) → 1 H2O(g) ∆H = -242 Kcal
A2 + B2 → 2 AB
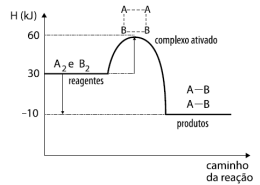
Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
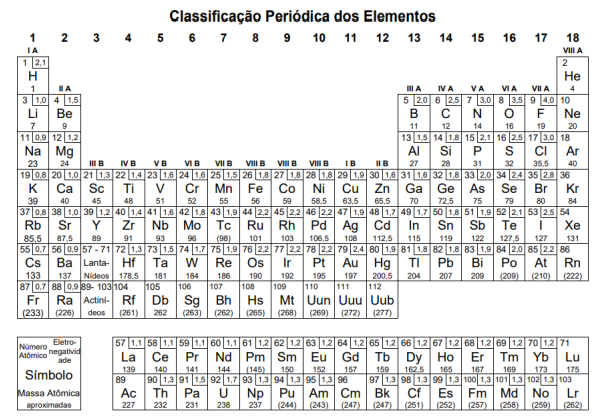
A tabela a seguir contém algumas dessas substâncias e suas respectivas entalpias de combustão (ΔHc0):
Substância Fórmula ΔHc 0 (kJ.mol-1 )
Metano CH4 –890
Butano C4H10 –2878
Octano C8H18 –5471
Metanol CH3OH –726
Etanol C2H5OH –1368
A substância que libera a maior quantidade de energia por grama de combustível é o
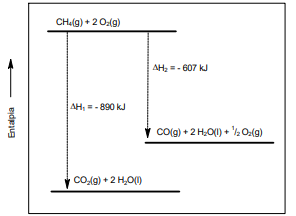
A partir dos dados apresentados, analise as afirmações:
I. Os valores de ΔH1 e ΔH2 indicam processos exotérmicos.
II. A energia envolvida na combustão parcial de 1 mol de metano é 890 kJ.
III. A combustão de 5 mols de monóxido de carbono (CO) libera 1415 kJ.
Está correto apenas o que se afirma em

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Conclui-se que a conversão da hematita para Fe(s) é
favorecida em temperaturas abaixo de 623 K.

Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que
 sejam as massas molares
da hidrazina e da amônia, respectivamente, a variação de entalpia
envolvida na quebra da amônia, caso o rendimento da reação
tivesse sido de 100%, seria
sejam as massas molares
da hidrazina e da amônia, respectivamente, a variação de entalpia
envolvida na quebra da amônia, caso o rendimento da reação
tivesse sido de 100%, seria 
Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1, 2 ou 3) representa a variação de entalpia da n-ésima etapa:

A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
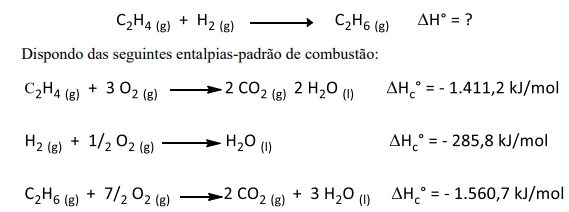
O ΔH° para a reação em questão, em kJ/mol, será igual a:
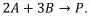
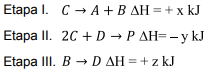
Assinale a alternativa que apresenta a expressão algébrica CORRETA para a variação de entalpia (∆H) da reação global.
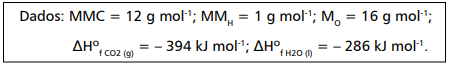
Considerando essas informações, o calor de formação estimado para a glicose, em kJ mol-1, é
H2SO4 + Ba(OH)2 → BaSO4 + 2 H2O
As entalpias-padrão de formação ( ΔH0form ) dos participantes da reação são apresentadas a seguir.
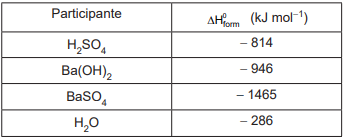
A variação de entalpia-padrão dessa reação, em kJ mol-1 , corresponde a
No que diz respeito a energia e ao primeiro princípio da termodinâmica, julgue o item a seguir.
Considere que 2.256,9 kJ de calor tenham sido adicionados a 1 kg de água líquida, vaporizando-a completamente à temperatura constante de 100 ℃ e à pressão constante de 101,33 kPa. Admitindo-se que os volumes específicos da água líquida e do vapor de água sejam, respectivamente, 0,00104 m3 /kg e 1,673 m3 /kg, é correto afirmar que, nas condições apresentadas, as variações de entalpia e de energia valem, respectivamente, menos de 2.090 kJ e mais de 2.250 kJ.
O gráfico que melhor representa a variação de entalpia (H) em função da pressão (P) neste processo é: