Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 366 questões
Tendo como referência o ensaio acima descrito e considerando os usos da gasolina, julgue o item que se segue.
A gasolina é bastante utilizada em geradores elétricos, os
quais produzem força eletromotriz que é totalmente
convertida em energia elétrica.
2 H2O ⇌ 2 H2 + O2
Considerando a reação de eletrólise da água mostrada acima, e sabendo que ZH = 1, ZO = 8, ZP = 15, MH = 1,0 g/mol, MO = 16,0 g/mol e que R = 0,082 atm ∙ L ∙ K−1 ∙ mol−1 é a constante universal dos gases perfeitos, julgue o item que se segue.
Supondo que todo o oxigênio produzido na eletrólise seja
lançado na atmosfera, então, a 1 atm de pressão e 298 K de
temperatura, uma tonelada de água submetida à eletrólise
lançará mais de 500.000 L de oxigênio na atmosfera.
Acerca da termoquímica, julgue o item subsequente.
Uma reação reversível que seja exotérmica em um sentido
será endotérmica no sentido oposto; se uma reação química
libera calor, ela é exotérmica; se, durante uma reação
química, calor é absorvido do meio, então a reação em
questão é endotérmica.
A estequiometria é aplicada em diversos estudos sobre a composição química de compostos e suas transformações químicas. No que se refere à estequiometria, julgue o item a seguir.
A estequiometria de uma reação apresenta a relação
qualitativa de reagentes formados e de produtos consumidos
nas diversas reações químicas indicadas por uma equação
química.
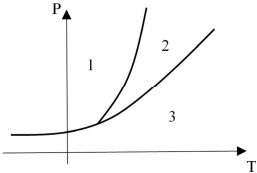
Na figura precedente, que corresponde ao diagrama de
fases de uma substância obtida a partir do fracionamento do
petróleo, as regiões 1, 2 e 3, delimitadas pelas curvas, estão
associadas aos estados físicos da substância, de acordo com as
condições de temperatura (T) e pressão (P).
Com base na figura e nas informações precedentes, julgue o próximo item.
A mudança de fase da substância do estado 1 diretamente
para o estado 3 corresponde ao que se denomina sublimação.
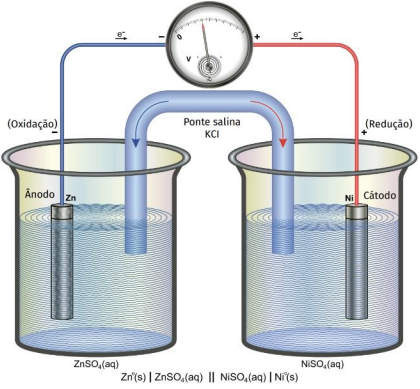
Julgue o seguinte item, em relação à eletroquímica.
O potencial da semirreação representada a seguir não depende do pH.
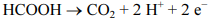
Julgue o seguinte item, em relação à eletroquímica.
Os potenciais-padrão das semirreações de oxirredução são
medidos com base no eletrodo-padrão de hidrogênio, cujo
valor estabelecido é 0,00 V.
Julgue o seguinte item, em relação à eletroquímica.
Considerando-se os potenciais de redução 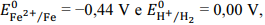 é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
é correto afirmar que
um prego de ferro colocado em uma solução de HCl 1 mol/L
permanece em seu estado inalterado.
Segundo a IUPAC, a dupla barra vertical na notação das pilhas eletroquímicas representa a ponte salina.
Observe a figura abaixo e considere a seguinte reação de eletrólise de NaCI aquoso 1 mol L-1:
Semicélula: 2Cl-(aq) → Cl2(g) + 2e-
Semicélula: 2e- + 2H2O → H2(g) + 2OH-(aq)
Célula: 2H2O(aq) + 2Cl-(aq) → H2(g) + Cl2(g) + 2OH-(aq)
Com base nas informações pode-se afirmar que:
Os principais meios corrosivos de materiais são os mecanismos químico e eletroquimico. No processo de corrosão eletroquímica, ocorre um fluxo de elétrons, que se desloca de uma área da superfície metálica para a outra. A diferença de potencial de natureza eletroquimica, se estabelece entre as regiões que envolvem transferência desses elétrons. As reações na corrosão eletroquimica são anódicas e catódicas (oxidação e redução). Assim, é correto afirmar que:
Em uma aula de eletroquímica, o professor construiu uma pilha usando os metais níquel e ferro e soluções 1,0 mol/L de sais de seus cátions. A figura representa um esquema da pilha.
São dados os potenciais padrão de redução dos metais.
Ni2+ (aq) + 2e- → Ni(s) E0 = - 0,25 V
Fe2+ (aq) + 2e- → Fe(s) E0 = - 0,44 V
Em relação a essa pilha, é correto afirmar que durante seu funcionamento a 25oC forma-se
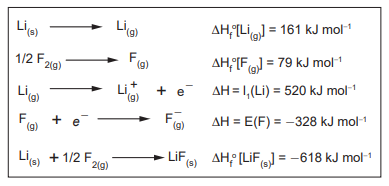
Nesse contexto, o valor aproximado da entalpia de rede (ΔHrede) para o LiF(s), em kJ mol-1 , é

Internet:<www.tabelaperiodica.org>
Acerca da espectroscopia de absorção molecular no ultravioleta e no visível, julgue o item.
À medida que o número de moléculas capazes de absorver luz de um determinado comprimento de onda aumenta, a extensão dessa absorção diminui, de acordo com a Lei de Lambert‑Beer expressa pela equação a seguir.
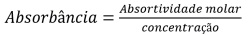
No que se refere à modificação de superfícies, julgue o seguinte item.
A funcionalização de superfícies antimicrobianas é uma
tecnologia que pode ser utilizada para desinfecção em vários
ramos da atividade humana, por exemplo, na esterilização de
dispositivos médicos para prevenir infecções hospitalares.
XCO3(s) → XO(s) + CO2(g)
Considerando-se a pureza do carbonato e a sua decomposição assumidamente completa, o elemento X em questão é o
Na Tabela a seguir, são apresentados três alcenos isômeros.
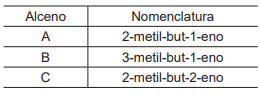
A representação em ordem crescente de energia liberada na combustão de 1 mol do alceno é a seguinte