Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 366 questões
( ) Na oxidação do ferro exposto ao tempo, no anodo ocorre a reação Fe → Fe2+ + 2e − e no catodo ocorre a reação O2 +4H + + 4e − → 2H2O.
( ) Uma forma de proteger a oxidação do ferro e fazer uma proteção catódica, é usar um metal de sacrifício como o magnésio. Isso ocorre pois o ferro possui um potencial de redução mais negativo que o magnésio.
( ) A proteção de superfícies metálicas da corrosão independe do meios corrosivos existentes, sendo o meio corrosivo, um fator secundário da corrosão.
Assinale a alternativa que apresenta a sequência correta de cima para baixo.
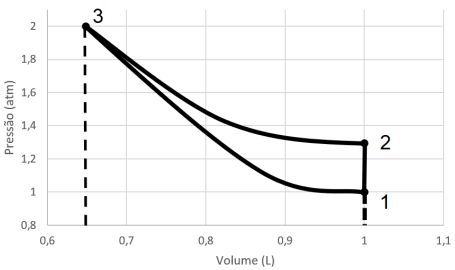
I. A variação de entropia ao longo do ciclo é nula. II. A variação de trabalho ao longo do ciclo é nula. III. A variação de energia interna ao longo do ciclo é nula.
Assinale

O quadro abaixo apresenta potenciais-padrão (E0) para semirreações de redução de cinco elementos.
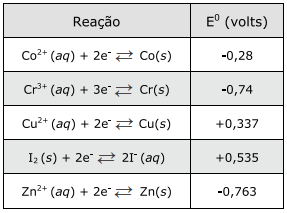
A ordem crescente de poder redutor conforme as
reações de redução acima é
Em um laboratório didático, para ensinar a tabela de potencial-padrão de redução (E0), foi construída uma pilha usando limão como eletrólito, conforme a figura.

Fonte: www.preparaenem.com/quimica/pilha-limao.htm
O laboratório dispunha dos metais apresentados no quadro a seguir.

Foi escolhido um fio de zinco como ânodo. Para que
a cela seja espontânea, como cátodo pode(m) ser
escolhido(s)
A reação que ocorre entre o permanganato de potássio e os íons Fe2+, em meio ácido, é representada pela equação não balanceada
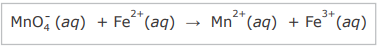
Em relação à reação, considere as afirmativas.
I - São necessários 4 íons H+ nos reagentes para balancear essa equação.
II - O íon Fe2+ é o agente redutor nessa reação.
III - O número de oxidação do íon manganês varia de +4 no reagente para +2 no produto.
Está(ão) correta(s)
Com relação às espectroscopias no infravermelho e no ultravioleta-visível, julgue o item subsecutivo.
A absorção de radiação no infravermelho é um processo
quantizado.
Com relação às espectroscopias no infravermelho e no ultravioleta-visível, julgue o item subsecutivo.
Os modos de movimento vibracional em uma molécula
ativos no infravermelho são os de estiramento e dobramento,
que dão origem a absorções.
Com relação às espectroscopias no infravermelho e no ultravioleta-visível, julgue o item subsecutivo.
A transição de energia vibracional na região do espectro
magnético corresponde ao ultravioleta-visível.
Considerando os aspectos termoquímicos, julgue o item que se segue.
Segundo a Lei de Hess, a avaliação de entalpia de uma
reação independe do estado inicial dos reagentes e do estado
final dos produtos.
Acerca dos gases, julgue o item a seguir.
A Lei de Boyle-Mariotte determina que, a uma temperatura
constante, o volume preenchido por certa massa de gás
é inversamente proporcional à pressão por ele exercida.
A série do tório, por exemplo, inicia-se pela sequência:
• 232Th90 → 228Ra88 + α • 228Ra88 → AXZ + β • AXZ → 228Th90 + β
O produto da segunda equação química é um núcleo
Considere os dados termoquímicos:
B2H6(g) + 3 O2(g) → B2O3(s) + 3 H2O(g) ΔHo= -1941 kJ mol–1 2 B(s) + 3/2 O2(g) → B2O3(s) ΔHo= -2368 kJ mol–1 H2(g) + 1/2 O2(g) → H2O(g) ΔHo= -241,8 kJ mol–1
A entalpia padrão de formação do diborano (em kJ mol–1) é
[Dados. Potenciais de redução padrão:
E0Al3+|Al = -1,66 V; E0Cu2+|Cu = +0,34 V.]
Nessas condições, analise as afirmativas a seguir a respeito desse sistema eletroquímico:
I. Será uma pilha, pois a reação esperada é espontânea. II. A diferença de potencial esperada é 7,32V. III. Será uma reação espontânea se um potencial externo de 2,00V for aplicado ao sistema.
Está correto o que se afirma em
No que concerne ao estado físico da matéria, julgue o item subsequente
A entropia de uma mesma substância é maior em estado
líquido do que em estado sólido.
Julgue o item a seguir, a respeito de soluções, densidade, concentração de soluções, diluição de soluções e volumetria.
As concentrações de soluções variam com a temperatura,
já que estão sujeitas a dilatações e contrações à medida que a
temperatura varia.
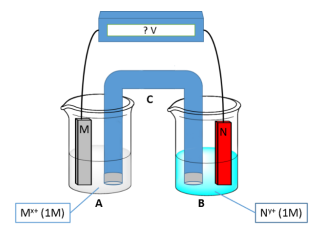
Com base nestas informação assinale a alternativa correta.
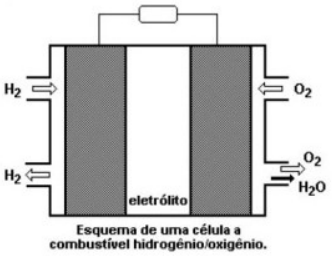
Sobre a pilha de hidrogênio, pode-se afirmar que
Observe a imagem.
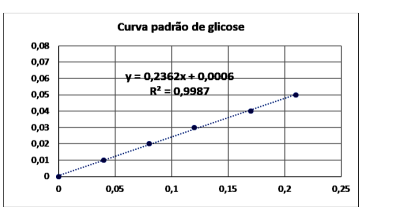
Dentre esses valores de absorbância obtidos, o que pode ser relacionado a concentração de 0,23 mg/mL é
