Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 366 questões
Observe o diagrama de energia a seguir.
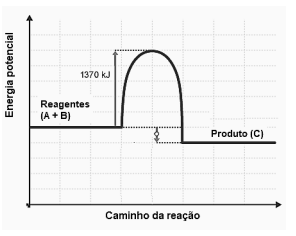
O diagrama se refere a uma reação do tipo
A2 + B2 → 2 AB
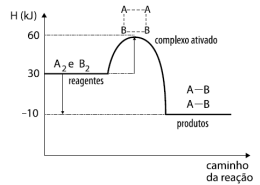
Disponível em: i_662d64349cafcb5b_html_55011cd1.png (463×350) (quimicaevestibular.com.br). Acesso em 27 de Julho de 2021.
Com relação ao gráfico acima, temos as seguintes afirmativas: I. A reação absorve calor; II. A energia de ativação da reação é 60 KJ; III. O valor da entalpia da reação (∆H) é de -40 KJ; IV. Ao colocarmos um catalisador na reação, diminuímos a sua entalpia (∆H), tornando-a mais rápida.
Estão corretas as afirmativas:
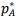 = 12 kPa e de B é
= 12 kPa e de B é 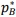 = 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta.
= 8 kPa. Considerando que a mistura líquida das duas substâncias a 80 °C apresenta pressão de vapor total p = 10 kPa, calcule a fração molar de A (yA) e de
B (yB) na fase vapor e assinale a alternativa correta. Atenção: a Tabela abaixo deve ser usada como apoio para responder a questão de Química.
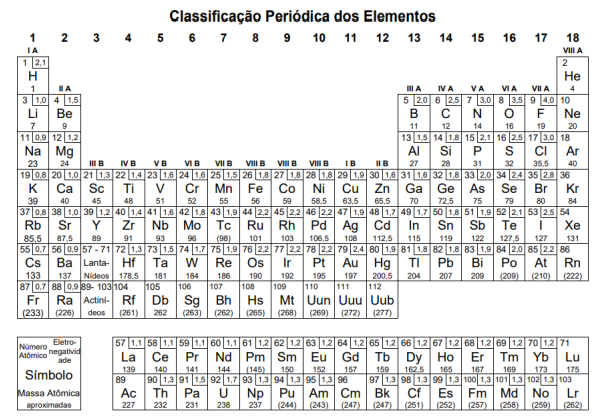
A tabela a seguir contém algumas dessas substâncias e suas respectivas entalpias de combustão (ΔHc0):
Substância Fórmula ΔHc 0 (kJ.mol-1 )
Metano CH4 –890
Butano C4H10 –2878
Octano C8H18 –5471
Metanol CH3OH –726
Etanol C2H5OH –1368
A substância que libera a maior quantidade de energia por grama de combustível é o
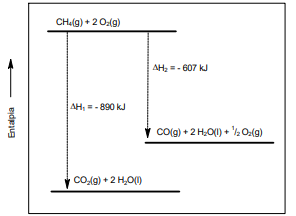
A partir dos dados apresentados, analise as afirmações:
I. Os valores de ΔH1 e ΔH2 indicam processos exotérmicos.
II. A energia envolvida na combustão parcial de 1 mol de metano é 890 kJ.
III. A combustão de 5 mols de monóxido de carbono (CO) libera 1415 kJ.
Está correto apenas o que se afirma em


Considerando que a análise do material brasileiro enviado tenha apresentado 5,2x103 desintegrações para o mesmo período de tempo, é possível estimar que a idade da amostra analisada, em anos, é, aproximadamente, igual a
(Dado: log 3,5 = 0,54; log 2 = 0,30)


Corrente Elétrica 10 A
Tempo 30 min
Pressão 1,0 atm
Temperatura 273 K
Sabendo que, nessas condições, foram recolhidos 1,7 L de gás hidrogênio é possível prever que o rendimento do processo foi, aproximadamente, de
(Dado: Constante de Faraday = 96.500 s.A.mol-1)
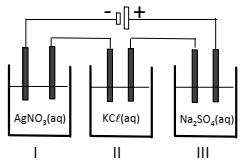
Cada cuba era constituída por um par de eletrodos inertes, continham soluções aquosas de AgNO3, KCl e Na2SO4 de mesma concentração e operaram durante um mesmo período de tempo em iguais condições.
A partir dessas informações, assinale V para a afirmativa verdadeira e F para a falsa.
( ) Na cuba I observa-se formação de gás no cátodo.
( ) Na cuba II o pH da solução aumenta ao longo do processo. ( ) Na cuba III um depósito sólido é formado no ânodo.
As afirmativas são, respectivamente,
A reação global do processo de transmutação descrito pode ser representada po
2 POCl3(g) → 2 PCl3(g) + O2(g)
Nas condições-padrão a 298 K, a variação de entalpia (ΔH0 ) e a variação de entropia (ΔS 0 ) para esse processo valem, respectivamente, 572 kJ e 179 J/K. A partir das informações apresentadas, analise as afirmações a seguir.
I. O processo de decomposição do cloreto de fosforila é endotérmico. II. O processo leva à diminuição da desordem do sistema. III. O processo é não-espontâneo nas condições-padrão.
Está correto apenas o que se afirma em
Cu(s) + NO3 – (aq) + H+ (aq) → Cu+2(aq) + NO(g) + H2O(l)
A soma dos menores inteiros que balanceiam corretamente a equação descrita é igual a

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Conclui-se que a conversão da hematita para Fe(s) é
favorecida em temperaturas abaixo de 623 K.

Considerando essas informações e os diversos aspectos a elas relacionados, julgue o item.
Na reação apresentada, o número de oxidação do ferro
passou de +3 para 0.
O fenômeno descrito acima é conhecido como

Essa reação ocorreu a partir de 0,07 m3 de uma mistura gasosa que possui 70% em massa de amônia e cuja densidade é 0,9 g/L. A eficiência do processo foi de 65% e foram observadas as seguintes reações químicas e respectivas variações de entalpia (∆Hn, em que n = 1 ou 2):

Nessa situação hipotética, considerando-se que
 sejam as massas molares
da hidrazina e da amônia, respectivamente, a variação de entalpia
envolvida na quebra da amônia, caso o rendimento da reação
tivesse sido de 100%, seria
sejam as massas molares
da hidrazina e da amônia, respectivamente, a variação de entalpia
envolvida na quebra da amônia, caso o rendimento da reação
tivesse sido de 100%, seria O decaimento radioativo do césio está representando no gráfico a seguir.

Considerando-se essas informações e sabendo-se que essa amostra radioativa deve ficar isolada por pelo menos 270 anos para que a massa restante (0,037 g) não represente um grande risco para a população, é correto inferir que a massa inicial da amostra contida no equipamento era

Caso essa reação seja realizada em etapas, as reações de cada etapa serão as seguintes, em que ∆Hn (n = 1, 2 ou 3) representa a variação de entalpia da n-ésima etapa:

A partir da Lei de Hess, é possível calcular a variação de entalpia envolvida na primeira reação.
Nessa situação, considerando-se que MFe = 56 g/mol seja a massa molar do ferro, é correto concluir que a variação de entalpia envolvida na formação de 140 g de ferro metálico por meio da redução do óxido ferroso pelo monóxido de carbono é
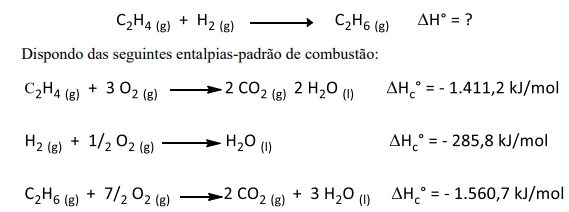
O ΔH° para a reação em questão, em kJ/mol, será igual a:
Atenção: Para responder à questão, considere as informações abaixo.
As baleias são os maiores seres vivos do planeta e importantes recicladores de nutrientes dos oceanos. Elas consomem uma quantidade colossal de alimento e suas fezes fertilizam as águas próximas à superfície. Por exemplo, uma baleia azul come cerca de 16 toneladas de peixes, lulas e pequenos crustáceos por dia. Hoje, apenas no oceano Austral, as baleias reciclam por ano, 1 200 toneladas de ferro, nutriente essencial para a reprodução do plâncton, organismos microscópicos que estão na base da cadeia alimentar marinha e contribuem para captar gás carbônico da atmosfera.
(Adaptado de: Revista Pesquisa Fapesp, dez. 2021)
Considerando que o ferro reciclado pelas baleias no oceano Austral anualmente esteja na forma de íons Fe3+ , a massa de íons cloreto necessária para neutralizar toda sua carga elétrica é, em toneladas, de, aproximadamente:
Dados:
Massas molares (g/mol)
Cℓ = 35,5;
Fe = 55,8