Questões de Concurso
Comentadas sobre transformações químicas e energia em química
Foram encontradas 1.182 questões
XCO3(s) → XO(s) + CO2(g)
Considerando-se a pureza do carbonato e a sua decomposição assumidamente completa, o elemento X em questão é o
Na Tabela a seguir, são apresentados três alcenos isômeros.
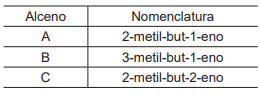
A representação em ordem crescente de energia liberada na combustão de 1 mol do alceno é a seguinte
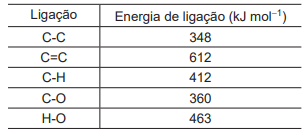
A variação de entalpia, em kJ mol-1 , da reação correspondente a esse processo industrial é
BrO3 - (aq) + 6 H+ (aq) + 6 e- → Br- (aq) + 3 H2 O (l) Eo red = +1,44 V
I2 (s) + 2 e- → 2 I- (aq) Eº red = +0,54 V
Em relação à pilha formada, observa-se que
I - C (s) + H2 O (v) → CO (g) + H2 (g) ∆H° = -28.000 cal mol-1 II - CO (g) + H2 O (v) → CO2 (g) + H2 (g) ∆H° = +9.400 cal mol-1 III - C (s) + 2 H2 O (v) → CO2 (g) + 2 H2 (g)
Considerando-se essas informações, a variação de entalpia, em cal mol-1 , da equação termoquímica III é
A relação entre essas grandezas é expressa por
Em um laboratório, foram realizadas quatro réplicas de uma análise de cromo em uma liga metálica, obtendo-se os seguintes valores: 14 mg g-1 , 10 mg g-1 , 16 mg g-1 e 12 mg g-1 .
Para esse conjunto de dados, o desvio-padrão, em mg g-1 , encontra-se na faixa entre
Nessa eletrólise, a substância simples formada no catodo é
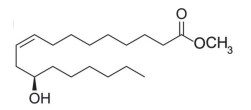
De acordo com as regras de nomenclatura da IUPAC, o nome do ricinoleato de metila é
Baseado no tamanho e no grau de espalhamento de luz incidente, calculou-se em 1 × 10-5 mol L-1 a concentração de AgNP na dispersão. A partir do tamanho médio, determinou-se que haveria 500 átomos de Ag por nanopartícula.
Considerando-se esses dados, verifica-se que a massa de prata, em mg, presente em 1 mL de dispersão é
Dado 1 mol = 6 x 1023 unidades M (Ag) = 108 g mol-1
CaCO3(s) → CaO(s) + CO2(g); ΔH0 = +179 kJ
Considerando-se o comportamento ideal do gás e o rendimento máximo da reação, a energia necessária, em MJ, para produzir 36 m3 de CO2 , medido nas condições normais de temperatura e pressão (CNTP) é, aproximadamente,
Dado R × T = 24,4 atm L mol-1 M = 106
Zn | Zn2+ (0,0010 M) | | Cu2+ (0,0010 M) | Cu
No laboratório, foram realizados três experimentos independentes para avaliar o comportamento dessa pilha galvânica, sendo eles:
(i) Adição de um excesso de amônia (NH3(g)) 1,0 M no compartimento catódico.
(ii) Adição de um excesso de amônia (NH3(g)) 1,0 M no compartimento anódico.
(iii) Adição de um excesso de amônia (NH3(g)) 1,0 M nos dois compartimentos simultaneamente.
De acordo com as condições mencionadas acima, assinale a alternativa correta quanto ao comportamento da pilha galvânica:
Considerando essa reação, assinale a alternativa correta:
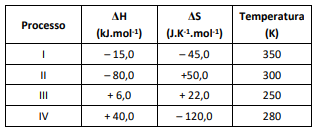
O processo espontâneo é o
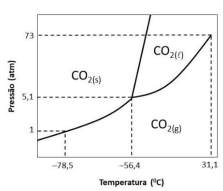
(*diagrama não desenhado em escala)
A partir das informações apresentadas avalie se as afirmativas a seguir são verdadeiras (V) ou falsas (F).
( ) Sob a condição de 5,1 atm e –56,40C prevalece o equilíbrio entre as fases sólida e gasosa.
( ) Sob a condição de 1,0 atm e –78,50C ocorre o ponto crítico para dióxido de carbono.
( ) Sob a condição de 73,0 atm e 31,1 atm ocorre o ponto de sublimação do dióxido de carbono.
As afirmativas são, respectivamente,
Considerando que a análise de um artefato encontrado por arqueólogos tenha apresentado atividade de carbono-14 equivalente a 10,7dpm.g-1 é possível estimar que a idade do artefato (em anos) é, aproximadamente, igual a
(Dados: use log 1,3 = 0,11 e log 2 = 0,3)
Qual o valor mais próximo, em quilojoules, da energia liberada nesse processo?