Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
Sobre os tipos de ligações, compostos químicos e reações químicas, assinale a alternativa CORRETA.
Substitua o (X) do texto pela alternativa CORRETA.
Com base na tendência da eletronegatividade na tabela periódica, assinale a afirmativa correta acerca da comparação entre as eletronegatividades dos elementos indicados.
Considere as seguintes massas atômicas: C = 12u, H = 1u, O = 16u.
Um litro de vinagre, uma solução de água e ácido acético, contém em média 0,06kg de ácido acético. Um cozinheiro utilizou uma colher de vinagre de volume 15mL para temperar uma salada. Sobre o tema, analise a afirmativas a seguir e assinale (V) para a verdadeira e (F) para a falsa.
( ) A concentração comum do ácido acético no vinagre é 60g/l.
( ) A massa de ácido acético na colher é 0,9g.
( ) No vinagre, o soluto é a água e o solvente é o ácido acético.
As afirmativas são, respectivamente.
O óxido de ferro (III), Fe2O3, presente no minério de ferro, pode ser reduzido por monóxido de carbono para produzir ferro no estado sólido e dióxido de carbono em alto-forno.
Fe2O3 s + CO g → Fe s + CO2(g)
Considere: MMFe = 56g/mol; MMO = 16g/mol; MMC = 12g/mol.
A esse respeito, analise as afirmativas a seguir e assinale (V) para a verdadeira e (F) para a falsa.
( ) São necessários 14,3g de Fe2O3 para produzir 10g de Fe.
( ) São necessárias 28,6g de Fe2O3 para produzir 10g de Fe.
( ) Na redução de 2mol de Fe2O3, são produzidos 44g de CO2
As afirmativas são, respectivamente,
I A energia de ionização diminui, em um grupo da tabela periódica, de cima para baixo.
II Os elementos do grupo 1 (metais alcalinos) possuem as maiores eletronegatividades na tabela periódica.
III O raio atômico dos elementos aumenta, em um período da tabela periódica, da esquerda para a direita.
IV O grupo 17 (halogênios) possui os maiores índices de eletroafinidade.
Das afirmativas, estão corretas
I Dissolução de sal (NaCl) em água. II Queima de um pedaço de papel. III Fusão de gelo em água. IV Fermentação de suco de uva.
Ela gostaria de identificar quais desses processos envolvem transformações químicas e quais envolvem transformações físicas. Em sendo assim, Luiza deve identificar, corretamente, que os itens
I.Por meio de aceleradores de partículas, que provocam choques violentos de partículas eletricamente carregadas contra átomos já existentes.
II.Pela colisão de núcleos de um mesmo átomo que seja estável.
A partir da análise dos itens, é possível AFIRMAR que:

Afinidades eletrônicas em kJ/mol para os elementos representativos dos primeiros cinco períodos da tabela periódica.
Sobre a afinidade eletrônica e a imagem, analise as afirmativas a seguir.
I. As afinidades eletrônicas do Be e do Mg são positivas porque o elétron adicionado está localizado em um subnível p anteriormente vazio que é de mais alta energia.
II. As afinidades eletrônicas dos elementos do grupo 5A têm subníveis p preenchidos pela metade; o elétron adicionado deve entrar em um orbital que já está ocupado, resultando em repulsões elétron-elétron maiores.
III.Os halogênios, que têm um elétron a menos para preencher completamente o subnível p, apresentam as afinidades eletrônicas mais negativas.
Está correto o que se afirma em
Mendeleev organizou os elementos da tabela periódica com propriedades semelhantes em colunas verticais, chamadas grupos ou famílias, e em linhas horizontais, chamadas períodos, em ordem crescente de massa atômica, em que as propriedades variam. A tabela periódica atual é constituída por 18 famílias e organizada de acordo com seus números atômicos.
Usberco, João; Salvador, Edgard. Química — volume único. 5. ed. reform. São Paulo: Saraiva, 2002.
Considere a seguinte representação de um elemento químico:

É correto afirmar que o número
(CH3)3CBr + OH– → (CH3)3COH + Br–
Considerando os dados apresentados, a lei de velocidade para a reação é:
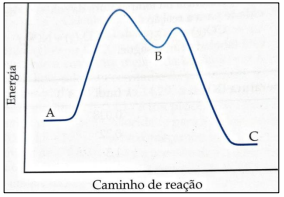
De acordo com o gráfico, analise as afirmativas a seguir.
I. Existe um intermediário B na reação A → C.
II. A reação total é exotérmica.
III. A etapa B → C é mais rápida.
Está correto o que se afirma em