Questões de Concurso
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 1.169 questões
A seguir são apresentadas as seguintes reações químicas:
(I) C + O2 → CO2
(II) 2 NaN3 → 2 Na + 3 N2
(III) HCl + NaOH → NaCl + H2O
Quanto à classificação dessas reações, é correto afirmar que:
Referente a esse reagente B, pode-se dizer que se trata de um reagente
NaCl(s) + AgNO3(s) → NaNO3(s) + AgCl(s)
Essa reação é classificada como
Assinale a alternativa que preencha corretamente a lacuna.
O processo ......................... da química visa a combinação de um agente químico específico com a mistura inflamável (vapores liberados do combustível e comburente), a fim de tornar essa mistura não inflamável.
Assinale a alternativa que completa corretamente a lacuna do texto.
O fogo nada mais é do que uma reação ............................ que libera luz e calor. Essa reação decorre de uma mistura de gases a altas temperaturas, que emite radiação geralmente visível.
Assinale a alternativa que completa corretamente a lacuna do texto.
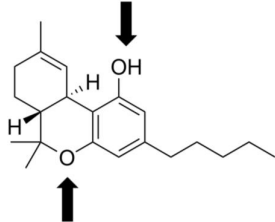
As setas apontadas para cima e para baixo indicam, respectivamente, os grupos funcionais
( ) Naturalmente, ao longo dos séculos, a eutrofização de um lago irá ocorrer na medida em que envelhece e os seus sedimentos preenchem o sistema aquático. No entanto, as descargas pontuais, bem como as cargas difusas de nutrientes limitantes, que incluem o nitrogênio e o fósforo, aceleraram a taxa e a magnitude da eutrofização, com consequências desastrosas para as fontes de água potável, a vida aquática, além de corpos hídricos recreativos.
( ) A principal característica dos corpos d'água eutróficos é a oscilação na direção do domínio das cianobactérias (algas verde-azuladas) que resulta na produção de toxinas, criando assim uma zona morta em um ecossistema aquático. A toxina produzida por cianobactérias mais comumente relatada é a hepatotoxina microcistina (MCs), aquela produzida em maior concentração e com tendência a bioacumular em animais aquáticos (como peixes) em comparação com outras toxinas.
( ) A ocorrência de baixos níveis de oxigênio dissolvido resultante da proliferação de algas leva a um menor número de peixes, diminuindo as fontes de alimento para os mamíferos e as aves. Além disso, a eutrofização restringe a penetração da luz solar na água, a qual é necessária para as plantas aquáticas submersas executarem a fotossíntese, resultando numa eventual eliminação do leito de plantas submersas.
As afirmativas são, respectivamente,
A respeito de reações químicas orgânicas, julgue o próximo item.
Reações exergônicas ocorrem quando a variação de energia
de Gibbs assume um valor negativo, significando que
energia foi absorvida do ambiente durante a reação.
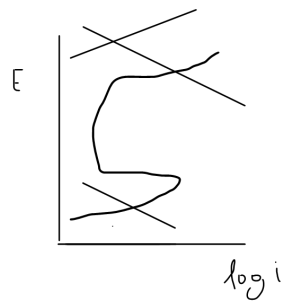
I. Na primeira etapa do teste, a amostra metálica deve ser polarizada anodicamente de forma galvanostática para surgimento do crévice.
II. Durante o ensaio são aplicadas duas diferentes técnicas de polarização: galvanostática e potenciostática.
III. O potencial de repassivação é definido como aquele em que a corrente aumenta continuamente em função do tempo.
Está(ão) correta(s) a(s) afirmativa(s)
Assinale a opção que melhor explica o comportamento de um par galvânico, em presença de íons cloreto, representado pela figura a seguir: