Questões de Concurso
Comentadas sobre transformações químicas em química
Foram encontradas 1.723 questões
25 mL de HCl aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
25 mL de CH3COOH aproximadamente 0,1 mol/L com NaOH padronizado como 0,1000 mol/L
São feitas as seguintes afirmações sobre as titulações:
I - O pH no ponto de equivalência é 7 em ambas as titulações.
II - O pH no ponto de equivalência é neutro na titulação HCl/NaOH e básico na titulação CH3COOH/NaOH.
III - O pH no ponto final é básico em ambas as titulações.
IV - O volume gasto em ambas será de aproximadamente 25 mL de NaOH.
Quais estão corretas?
(1) Ácido de Lewis ( ) NH3
(2) Base de Arrhenius ( ) CH3COOH
(3) Base fraca de Bronsted-Lowry ( ) KNO3
(4) Ácido forte de Bronsted-Lowry ( ) HCl
(5) Componente ácido de tampão ( ) NH4Cl
(6) Componente salino de tampão ácido ( ) BF3
(7) Sal ácido ( ) CH3COONa
(8) Sal neutro ( ) KOH
A sequência numérica correta de preenchimento dos parênteses da coluna da direita, de cima para baixo, é
H2S LiOH CuBr2 NaNO3 KF SO3 Na2O
Pode-se afirmar que as soluções apresentam, da esquerda para a direita, valores de pH a 25 ºC, conforme listados a seguir:
I - A temperatura de equilíbrio será 50 ºC.
II - A água fria sofre aumento de energia interna e de entropia.
III - A água fria sofre aumento de entalpia e diminuição de entropia.
IV - A água quente sofre diminuição de energia interna e aumento de entropia.
Quais estão corretas?
I - Fórmula química do solvente e concentração da solução de limpeza.
II - Concentração comum da solução e concentração molar do soluto.
III - Peso dos metais pesados na solução final e concentração da solução salina.
Quais correspondem aos principais cálculos que devem ser utilizados no preparo de soluções?
No que se refere a noções de tabela periódica, ligação química e estrutura molecular, julgue o item seguinte.
Os elementos da coluna 4A da tabela periódica possuem
quatro elétrons na última camada e, por isso, não apresentam
tendência para perder ou ganhar elétrons e sim para
compartilhar seus elétrons com outros átomos.
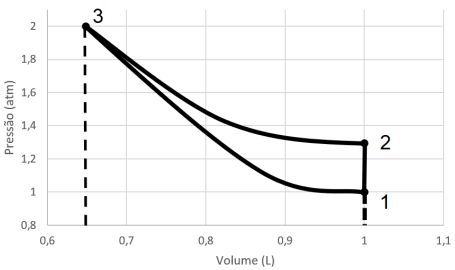
Acerca dos gases, julgue o item a seguir.
A alteração de volume de uma determinada massa de um gás
provocada pela alteração de pressão a uma temperatura
constante é uma transformação isotérmica.
Em análises cromatográficas, a separação dos componentes da amostra é efetuada na coluna, em que a natureza do suporte sólido, o método de empacotamento, o comprimento, o diâmetro e a temperatura de operação são fatores importantes para obter-se a resolução desejada, com a respectiva identificação dos componentes pelo detector. Acerca desse assunto, julgue o item subsecutivo.
Em uma coluna de cromatografia gasosa, quando se diminui
o tamanho da partícula do suporte, aumenta-se a pressão do
gás requerida para se atingir o fluxo através da coluna.
No processo de vaporização com a pressão constante de substâncias puras a partir do seu estado líquido, onde não há variação de temperatura, mas uma transferência de calor das vizinhanças para a substância, ocorre um efeito térmico de mudança de fases. Julgue o próximo item, relativo ao processo de efeitos térmicos que acompanham a mudança de fase de substâncias puras.
Os calores latentes de vaporização — a energia necessária
para realizar a mudança de estado líquido de uma substância
pura para o estado gasoso —, no caso dos álcoois, são
maiores que os dos alcanos acíclicos, considerando-se
cadeias com o mesmo número de átomos de carbono.
No processo de vaporização com a pressão constante de substâncias puras a partir do seu estado líquido, onde não há variação de temperatura, mas uma transferência de calor das vizinhanças para a substância, ocorre um efeito térmico de mudança de fases. Julgue o próximo item, relativo ao processo de efeitos térmicos que acompanham a mudança de fase de substâncias puras.
Existem métodos para estimar o calor latente de vaporização
de um líquido puro em qualquer temperatura a partir de um
valor conhecido em uma dada temperatura.
