Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
A esse respeito, avalie as afirmações relacionadas aos diferentes modelos atômicos de Rutherford.
I - O átomo é indivisível.
II - O próton é uma partícula subatômica de carga elétrica semelhante, em módulo, à do elétron.
III - A maior parte da massa do átomo tem carga positiva e está localizada numa região denominada núcleo.
IV - Raios catódicos são constituídos por um fluxo de partículas carregadas negativamente e de tamanho inferior ao do átomo.
V - Os elétrons são muito mais leves que os prótons e são encontrados ao redor do núcleo, em uma região denominada eletrosfera.
Está correto apenas o que se afirma em
O processo ......................... da química visa a combinação de um agente químico específico com a mistura inflamável (vapores liberados do combustível e comburente), a fim de tornar essa mistura não inflamável.
Assinale a alternativa que completa corretamente a lacuna do texto.
O fogo nada mais é do que uma reação ............................ que libera luz e calor. Essa reação decorre de uma mistura de gases a altas temperaturas, que emite radiação geralmente visível.
Assinale a alternativa que completa corretamente a lacuna do texto.
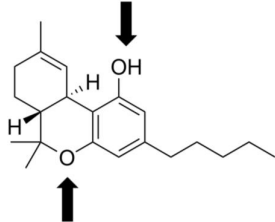
As setas apontadas para cima e para baixo indicam, respectivamente, os grupos funcionais
( ) Naturalmente, ao longo dos séculos, a eutrofização de um lago irá ocorrer na medida em que envelhece e os seus sedimentos preenchem o sistema aquático. No entanto, as descargas pontuais, bem como as cargas difusas de nutrientes limitantes, que incluem o nitrogênio e o fósforo, aceleraram a taxa e a magnitude da eutrofização, com consequências desastrosas para as fontes de água potável, a vida aquática, além de corpos hídricos recreativos.
( ) A principal característica dos corpos d'água eutróficos é a oscilação na direção do domínio das cianobactérias (algas verde-azuladas) que resulta na produção de toxinas, criando assim uma zona morta em um ecossistema aquático. A toxina produzida por cianobactérias mais comumente relatada é a hepatotoxina microcistina (MCs), aquela produzida em maior concentração e com tendência a bioacumular em animais aquáticos (como peixes) em comparação com outras toxinas.
( ) A ocorrência de baixos níveis de oxigênio dissolvido resultante da proliferação de algas leva a um menor número de peixes, diminuindo as fontes de alimento para os mamíferos e as aves. Além disso, a eutrofização restringe a penetração da luz solar na água, a qual é necessária para as plantas aquáticas submersas executarem a fotossíntese, resultando numa eventual eliminação do leito de plantas submersas.
As afirmativas são, respectivamente,
Sabendo que uma pessoa libera 1 kg CO2/dia, calcule quantos kg de LiOH serão necessários em uma missão espacial composta por 30 pessoas e com duração de 15 dias.
Para fins de cálculo, as massas moleculares em g/mol são: H=1; C=12; O=16; Li=7.
A + A + B
 C + D
C + D A molecularidade dessa reação é:
A respeito de reações químicas orgânicas, julgue o próximo item.
Reações exergônicas ocorrem quando a variação de energia
de Gibbs assume um valor negativo, significando que
energia foi absorvida do ambiente durante a reação.
Acerca dos métodos analíticos para caracterização e identificação de resíduos e impurezas, julgue o item que se segue.
As soluções utilizadas para avaliação da linearidade de um
método analítico devem ser preparadas de maneira
independente, devendo ser utilizadas soluções diluídas de
uma mesma solução-mãe da solução química de
referência (SQR).
No caso de métodos cromatográficos, deve ser comprovada a pureza cromatográfica do sinal do analito, inclusive em amostras biológicas.
I. Na primeira etapa do teste, a amostra metálica deve ser polarizada anodicamente de forma galvanostática para surgimento do crévice.
II. Durante o ensaio são aplicadas duas diferentes técnicas de polarização: galvanostática e potenciostática.
III. O potencial de repassivação é definido como aquele em que a corrente aumenta continuamente em função do tempo.
Está(ão) correta(s) a(s) afirmativa(s)
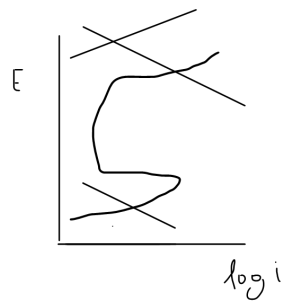
Assinale a opção que melhor explica o comportamento de um par galvânico, em presença de íons cloreto, representado pela figura a seguir:
I. A FS ocorre em meio com presença de água livre e normalmente com substratos solúveis, como a que ocorre para fermentação submersa do caldo de cana-de-açúcar usado para produção de etanol.
II. A utilização da FMSS privilegia a sustentabilidade ambiental que vem sendo prioridade das políticas de pesquisa agropecuária em quase todo o mundo e se baseia na utilização racional dos recursos naturais e de resíduos agrícolas e industriais, viabilizando a obtenção de produtos com custo mais reduzido.
III. A simplicidade do meio, principalmente para países com abundância de biomassa e de resíduos agroindustriais, e o uso de reatores menores, proporcionando economia de espaço e, ainda, a possibilidade dos rendimentos serem maiores que os obtidos em FS, além da ausência de formação de espuma, menor demanda de energia e, especialmente, a facilidade de controle de contaminação proporcionada pela pouca quantidade de água no sistema compreendem muitas das distintas vantagens que o uso da técnica de FMSS oferece sobre a FS.
Assinale