Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
Em relação aos conceitos de mol, massa molar e concentração de soluções, julgue o item.
Conceitualmente, é correto afirmar que uma entidade elementar equivale a 6,022×1023 mols.
Para cada mol de ácido fosfórico, são necessários três mols de hidróxido de sódio para produzir um mol de fosfato de sódio (Na₃PO₄) e três mols de água.
O hidrogênio tem capacidade de reagir com metais ativos para formar hidretos metálicos sólidos, como, por exemplo: 2Na(s) + H2(g) → 2NaH(s).
Ao misturar AgNO3 e NaCl em solução aquosa, formará um sal insolúvel (NaNO3) e um sal solúvel (AgCl).
(1) Combustão. (2) Decomposição.
( ) 2H2O2 → 2H2O + O2 ( ) 2KBrO3 → 2KBr + 3O2 ( ) CH4 +2O2 → 2H2O + CO2
O(A) ___________ de um elétron é conhecido(a) como __________, e o átomo ou a molécula que perde o elétron se diz __________. O(A) __________ é ao contrário, o(a) ____________ de um elétron tornando o átomo ou molécula _________. As reações de oxidação e redução sempre ocorrem simultaneamente.
Pode-se obter o bórax anidro (Na2B4O7) através da reação representada pela equação não balanceada:
Ácido bórico + Metaborato de sódio → Na2B4O7 + H2O
A alternativa que apresenta as fórmulas corretas dos reagentes utilizados para sintetizar o bórax é:

A reação química entre sulfato ferroso e permanganato de potássio em meio ácido é representada pela seguinte reação química:
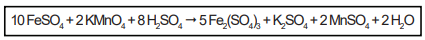
Nessa reação, o elemento químico que sofre oxidação tem como símbolo:
A fórmula química desse composto corresponde a:
NaHCO3(s) + H3 O+ (aq) → Na+ (aq) + 2H2 O(l) + CO2(g)
Considerando-se a proporção estequiométrica e o rendimento completo de reação, a massa de bicarbonato de sódio necessária para neutralizar 20,0 L de solução aquosa, cujo pH medido foi 2, é
Nessa situação final, a temperatura do balão, em K, é
Dado T(K) = T(°C) + 273
Por volta de 1920, dois cientistas, o bioquímico russo Aleksandr I. Oparin (1894 - 1980) e o biólogo inglês John B. S. Haldane (1892 - 1964) apresentaram seus resultados baseados no estudo da teoria da evolução química do biólogo inglês Thomas H. Huxley (1825 - 1895). Segundo a teoria, a Terra primitiva continha compostos químicos inorgânicos, que combinados a fenômenos físicos como descargas elétricas produziriam compostos orgânicos, que são a base da vida na Terra. Porém, esta hipótese só foi testada em laboratório em 1953 pelos cientistas Stanley L. Miller (1930 - 2007) e Harold C. Urey (1893 - 1981).
PILLING, S. Química prebiótica e formas de vida primitiva. Astroquímica, Universidade do Vale da Paraíba. Disponível em: <https://www1.univap.br/spilling/AQ/Aula%2015%20- %20Quimica%20prebiotica.pdf>. Acesso em: 13 ago. 2023.
A hipótese de Oparin e Haldane foi testada por Miller e Urey, que inseriram em um sistema fechado vapor de água e os gases
C5H12(g) + O2(g) → CO2(g) + H2O(g)
Atente para as seguintes afirmações referentes às relações dos volumes dos reagentes consumidos e dos produtos obtidos.
I. A relação entre os volumes de C5H12(g) consumido e de CO2(g) obtido é de 2:5.
II. A relação entre os volumes de O2(g) consumido e de CO2(g) obtido é de 8:5.
III. A relação entre os volumes de C5H12(g) consumido e de H2O(g) obtido é de 1:6.
É correto o que se afirma em