Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões
1. eletronegatividade; 2. energia de ionização; 3. afinidade eletrônica; 4. eletropositividade.
( ) Energia liberada quando um elétron adicional é acrescentado a um átomo no estado gasoso.
( ) Energia mínima necessária para remover um elétron de um átomo ou íon no estado gasoso.
( ) Tendência do átomo em doar elétrons durante as ligações químicas.
( ) Tendência que um átomo tem de atrair elétrons para si em uma ligação química em uma molécula isolada.
A sequência correta, de cima para baixo, é:
I. Na tabela periódica, o volume atômico dos elementos não varia periodicamente, ou seja, não varia em intervalos regulares.
II. A massa atômica dos elementos químicos varia periodicamente com o aumento ou diminuição do número atômico.
Considerando as proposições acima apresentadas, é correto afirmar que
Etapa 1: 2 NO(g)
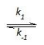 N2O2(g) (rápida, equilíbrio)
N2O2(g) (rápida, equilíbrio) Etapa 2: N2O2(g) + Br2(g)
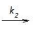 2NOBr (lenta)
2NOBr (lenta) A constante de velocidade para a reação entre óxido nítrico e bromo pode ser expresso em função das constantes k1, k-1 e k2 por meio da expressão:
Admitindo que não há reação química entre as substâncias, e que na mistura ocorra a aditividade das massas e dos volumes, a densidade do material confeccionado pode ser expressa como:
Observe a tabela a seguir, na qual uma propriedade periódica X é apresentada, com unidade de medida adequada, para três elementos químicos.
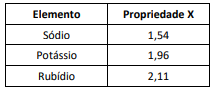
A propriedade representada por X é
Atualmente tais processos podem ser classificados como reações de
Para essas moléculas, as geometrias espaciais são, respectivamente,
ClO− (aq) + 3I− (aq) + 2H+ (aq) → I 3 − (aq) + Cl− (aq) + H2 O (L)
Considere, hipoteticamente, que essa reação rápida forneceu os seguintes dados experimentais:
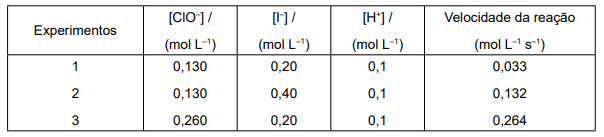
Com base nos dados experimentais, qual é a expressão matemática que descreve a lei de velocidade?
Com relação às mudanças de estado físico da matéria e à calorimetria, julgue o item subsequente.
Além dos estados sólido, líquido e gasoso, há o plasma, que
é a condição da matéria associada a partículas muito
energizadas, com certo distanciamento e nenhuma ou pouca
ligação entre si, e cujas propriedades são semelhantes às do
estado líquido, mas com uma energia cinética maior.
Sobre esse fenômeno, analise as possíveis explicações abaixo sobre o caso:
1. O ponto de ebulição da água aumenta com a adição de sal, pois há um aumento da intensidade da força de coesão entre os íons do sal e as moléculas da água.
2. A adição do sal resulta em uma diminuição da temperatura de ebulição da água.
3. A pressão de vapor da água aumenta devido à atração das moléculas da água com os íons do sal, o que dificulta a evaporação.
4. O abaixamento da pressão de vapor, em soluções diluídas, é diretamente proporcional à concentração do soluto.
Assinale a alternativa que indica todas as afirmativas corretas.
Nesse caso, assinale a alternativa que indica corretamente o que deve ser realizado.
Assinale a alternativa correta em relação ao assunto.
Com base nessas informações, assinale a alternativa que indica, respectivamente, o número atômico (Z) e o número de massa (A) desse átomo.
Assinale a alternativa que indica corretamente a composição nuclear que o átomo do elemento químico fósforo apresenta.
Fonte: Reações Químicas. Disponível em:<http://www.foz.unioeste.br/~lamat/downquimica/capitulo5.pdf>.
Marque a alternativa que descreve CORRETAMENTE sobre essas reações.
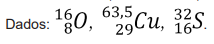
I - Os biopolímeros são polímeros produzidos a partir de matérias-primas de fontes renováveis e que possuem fácil processabilidade industrial.
II - Os polímeros oxo-biodegradáveis são polímeros que possuem aditivos que aceleram sua degradação oxidativa na presença de luz ou calor.
III - A compostagem é um processo de degradação térmica dos polímeros.
IV - Os Polímeros Verdes são polímeros encontrados na natureza.
As afirmações corretas são: