Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 2.096 questões

Considerando a combustão completa de 26 g de cada uma das substâncias que podem ser usadas como combustíveis, a substância que irá emitir mais dióxido de carbono é:

Afinidades eletrônicas em kJ/mol para os elementos representativos dos primeiros cinco períodos da tabela periódica.
Sobre a afinidade eletrônica e a imagem, analise as afirmativas a seguir.
I. As afinidades eletrônicas do Be e do Mg são positivas porque o elétron adicionado está localizado em um subnível p anteriormente vazio que é de mais alta energia.
II. As afinidades eletrônicas dos elementos do grupo 5A têm subníveis p preenchidos pela metade; o elétron adicionado deve entrar em um orbital que já está ocupado, resultando em repulsões elétron-elétron maiores.
III.Os halogênios, que têm um elétron a menos para preencher completamente o subnível p, apresentam as afinidades eletrônicas mais negativas.
Está correto o que se afirma em
Mendeleev organizou os elementos da tabela periódica com propriedades semelhantes em colunas verticais, chamadas grupos ou famílias, e em linhas horizontais, chamadas períodos, em ordem crescente de massa atômica, em que as propriedades variam. A tabela periódica atual é constituída por 18 famílias e organizada de acordo com seus números atômicos.
Usberco, João; Salvador, Edgard. Química — volume único. 5. ed. reform. São Paulo: Saraiva, 2002.
Mendeleev organizou os elementos da tabela periódica com propriedades semelhantes em colunas verticais, chamadas grupos ou famílias, e em linhas horizontais, chamadas períodos, em ordem crescente de massa atômica, em que as propriedades variam. A tabela periódica atual é constituída por 18 famílias e organizada de acordo com seus números atômicos.
Usberco, João; Salvador, Edgard. Química — volume único. 5. ed. reform. São Paulo: Saraiva, 2002.
Mendeleev organizou os elementos da tabela periódica com propriedades semelhantes em colunas verticais, chamadas grupos ou famílias, e em linhas horizontais, chamadas períodos, em ordem crescente de massa atômica, em que as propriedades variam. A tabela periódica atual é constituída por 18 famílias e organizada de acordo com seus números atômicos.
Usberco, João; Salvador, Edgard. Química — volume único. 5. ed. reform. São Paulo: Saraiva, 2002.
Mendeleev organizou os elementos da tabela periódica com propriedades semelhantes em colunas verticais, chamadas grupos ou famílias, e em linhas horizontais, chamadas períodos, em ordem crescente de massa atômica, em que as propriedades variam. A tabela periódica atual é constituída por 18 famílias e organizada de acordo com seus números atômicos.
Usberco, João; Salvador, Edgard. Química — volume único. 5. ed. reform. São Paulo: Saraiva, 2002.
I. Os cátions apresentam o número de prótons menor que o número de elétrons.
II. Íon é uma espécie química que apresenta o número de prótons igual do número de elétrons.
III. Os cátions se formam quando um átomo perde um ou mais elétrons, resultando num sistema eletricamente positivo.
IV. Os ânions se formam quando um átomo ganha ou recebe um ou mais elétrons, resultando num sistema eletricamente negativo.
É INCORRETO o que se afirma apenas em
Considere a seguinte representação de um elemento químico:

É correto afirmar que o número
(CH3)3CBr + OH– → (CH3)3COH + Br–
Considerando os dados apresentados, a lei de velocidade para a reação é:
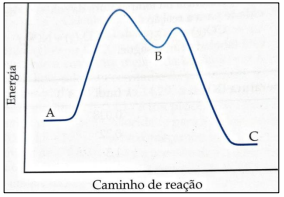
De acordo com o gráfico, analise as afirmativas a seguir.
I. Existe um intermediário B na reação A → C.
II. A reação total é exotérmica.
III. A etapa B → C é mais rápida.
Está correto o que se afirma em
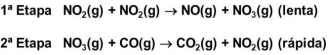
I. O intermediário NO3(g) é produzido lentamente na etapa 1 e é imediatamente consumido na etapa 2.
II. A lei de velocidade da reação é V = K [NO2]2 .
III. A etapa 2 é muito mais rápida que a etapa 1, isto é K2>>K1.
Está correto o que se afirma em

*elemento e informações fictícias.
Com base nos dados apresentados, a massa atômica que representa o Eterium é:

Uma forma de se trabalhar em sala e que facilita o processo de aprendizagem dos estudantes de forma lúdica é a representação visual, que pode ser feita com modelos, desenhos ou esquemas que simplificam e concretizam aqueles conhecimentos. Um dos temas que podem ser favorecidos por tal abordagem é o dos modelos atômicos, que formam um dos pilares da ciência moderna. Observe na imagem do super-herói Nuclear os símbolos atômicos representados:

Disponível em: https://mutantexis.wordpress.com/2015/01/11/eis-o-nuclear/. Acesso em: 28 jul. 2024.
Qual o modelo atômico correto correspondente à imagem?