Questões de Concurso
Sobre transformações químicas em química
Foram encontradas 1.966 questões
Considere a tabela abaixo para responder a questão 38.
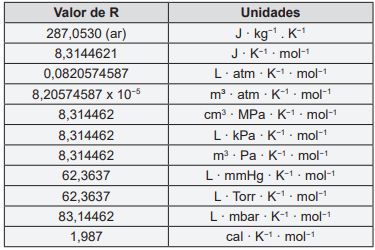
Massas atômicas (u): C = 12,01, O = 16,00, H = 1,01
Analise as seguintes afirmativas e a seguir assinale a alternativa correta:
I. Um tanque de oxigênio armazenado fora de um edifício tem uma pressão de 20,00 atm às 6:00 h da manhã, quando a temperatura está em torno de 10°C. A pressão no tanque às 18:00 h quando a temperatura chega a 30°C é 21,41 atm.
II. Um motor de automóvel mal ajustado pode liberar, em marcha lenta, até 1,00 mol de monóxido de carbono por minuto. A 27°C, o volume desse gás, a 1 atm de pressão que pode ser liberado por minuto é 24,61 L.
III. O óleo produzido a partir de folhas de eucalipto contém o composto volátil eucaliptol. Esse composto tem densidade 0,320 g L-1 a 190°C e 60,0 mmHg. A massa molar do eucaliptol gasoso é 153,89 g mol-1.
IV. O volume de gás carbônico (a 25°C e 1 atm) necessário para que uma planta produza 1,00 g de glicose (C6H12O6) por fotossíntese é 815 mL.
V. A composição do ar seco, em volume, é: 78% de nitrogênio, 21% de oxigênio e 1% de argônio. As pressões parciais desses gases no ar a uma pressão atmosférica de 1 atm são respectivamente, p(N2) = 0,78 atm, p(O2) = 0,21 atm e p(Ar) = 0,01 atm.
Assinale a alternativa correta:
Muitas reações químicas inorgânicas podem ser classificadas em reações de síntese ou de análise ou de simples troca ou de dupla troca. Nesse contexto, relacione a COLUNA II com a COLUNA I, classificando as reações químicas.
COLUNA I
1. Reação de síntese
2. Reação de análise
3. Reação de simples troca
4. Reação de dupla troca
COLUNA II
( ) 3 H2(g) + N2(g) → 2 NH3(g)
( ) NaCl + AgNO3 → AgCl + NaNO3
( ) 2 NaN3(s) → 3 N2(g) + 2 Na(s)
( ) 2 Fe(s) + 6 HCl(aq) → 2 FeCl3(aq) + 3 H2(g)
Assinale a sequência correta.
6NH4 ClO4 (s) + 10Al (s) → 5Al2 O3 (s) + 3N2 (g) + 6HCl (g) + 9H2O (g)
Considerando que se colocou para reagir 1 kg do perclorato de amônio com 1 kg do alumínio, quanto, aproximadamente, de massa, em gramas, do óxido foi produzido na reação?
COLUNA I 1. Hidrogênio 2. Oxigênio 3. Nitrogênio 4. Flúor
COLUNA II ( ) É encontrado em duas formas moleculares gasosas, sendo que uma delas é extremamente tóxica e a outra é um não combustível pouco solúvel em água. ( ) É encontrado na forma de gás e extremamente importante na composição química das proteínas, que são moléculas presentes em todos os organismos vivos. ( ) Na forma molecular, é um gás, à temperatura ambiente, amarelo pálido e apresenta elevada reatividade. ( ) É encontrado na natureza como gás diatômico incolor e inflamável muito útil na produção de gás amoníaco.
Assinale a sequência CORRETA.
As figuras a seguir apresentam micrografias dos três tipos citados de alotropia do Fe e diferentes esquemas de estrutura atômica.
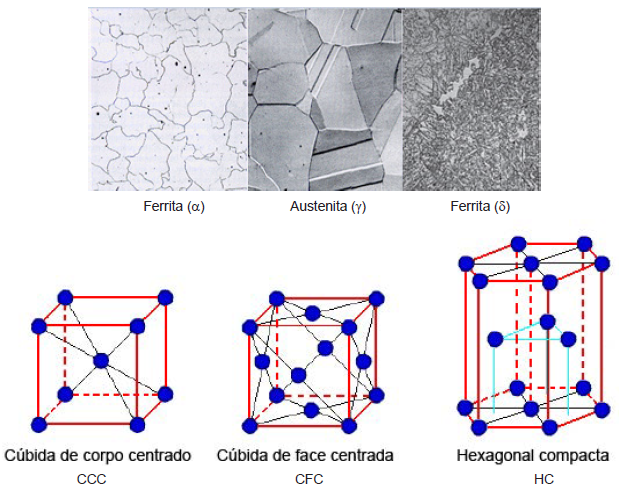
Assinale a alternativa que apresenta a correta associação entre a fase do ferro e sua estrutura atômica.
Análises químicas mostraram que um lote de carvão específico contém 2% de enxofre em massa. Quando esse carvão é queimado, o enxofre é convertido em gás dióxido de enxofre.
Considerando que nesse processo todo o dióxido de enxofre produzido da queima do carvão reagiu completamente com óxido de cálcio produzindo 2 mil toneladas de sulfito de cálcio, é correto afirmar que a massa aproximada, em toneladas, de carvão queimado é:
Um dos processos químicos industriais mais importantes que existem é a produção de amônia a partir de hidrogênio e nitrogênio. Este processo ocorre a altas temperaturas e pressões (>450ºC e 200 atm) e pode ser representado pela seguinte reação: N2(g) + 3 H2(g) → 2 NH3(g). Calcule a quantidade (em gramas) de N2 necessário para conseguir 5,0 mol de NH3 e a quantidade (em mol) de NH3 obtido a partir de 2,0 mol H2 . Dados: 1 mol de N = 14 g, 1 mol de H = 1 g.
Assinale a alternativa que possui ambas respostas corretas.
Um dos grandes problemas ambientais que ocorrem nas grandes cidades é a formação das chuvas ácidas, que ocorrem na seguinte ordem de reações:
I. Quando o oxigênio e o nitrogênio do ar reagem nos motores dos automóveis, o óxido nítrico é formado.
II. Depois de formado e lançado pelos escapamentos, este reage com o oxigênio formando o dióxido de nitrogênio.
III. Este último reage com a água, formando um dos componentes da chuva ácida.
2 Cu(NO3)2 (s) → 2 CuO(s) + 4 NO2 (g) + O2 (g)
Admitindo comportamento de gás ideal para os produtos gasosos formados, 100% de redimento e que o processo ocorre nas CNTP, o volume total, em litros, de gases formados na decomposição de 3750 g Cu(NO3)2 , corresponde a
Dados Massa molar do Cu(NO3)2 : 187,5 g mol-1 Volume molar nas CNTP: 22,4 L
"A pedra constituída
De ferro, níquel e encanto.
Até o dia de hoje
Provoca tristeza e encanto
Queremos nossa pedra de volta
De volta pro nosso canto."
Cordel: A Saga da Pedra do Bendegó.
A pedra do Bendegó foi encontrada próximo ao riacho de Bendegó, na Bahia, na cidade de Monte Claro, em 1784. Bendegó é um
Em 1897, foi realizado no famoso laboratório de Cavendish, em Cambridge, um experimento usando tubos de raios catódicos. O pesquisador que o executou estava investigando a constituição da matéria.
Este experimento foi feito por


